[Năm 2022] Đề thi thử môn Hóa THPT Quốc gia có lời giải (30 đề)
[Năm 2022] Đề thi thử môn Hóa THPT Quốc gia có lời giải (Đề 6)
-
10241 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Cho m gam hỗn hợp gồm axit axetic, axit oxalic, axit glutamic tác dụng vừa đủ với V ml dung dịch NaOH 1M thu được dung dịch chứa (m + 8,8) gam muối. Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Axit + NaOH → muối + H2O
Theo PTHH ⟹ nNaOH = nH2O
Sử dụng bảo toàn khối lượng ⟹ nNaOH ⟹ VNaOH.
Giải chi tiết:
Axit + NaOH → muối + H2O
Theo PTHH ⟹ nNaOH = nH2O = x (mol)
Áp dụng định luật bảo toàn khối lượng ta có
maxit + mNaOH = mmuối + mH2O
⟹ m + 40x = m + 8,8 + 18x
⟹ x = 0,4 (mol).
Vậy V = VNaOH = n/CM = 0,4/1 = 0,4 (lít) = 400 ml.
Câu 2:
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Dựa vào tính chất hóa học của NaHSO4 và các hợp chất trong đáp án.
Giải chi tiết:
X không thể là NaAlO2 vì sau khi tạo Al(OH)3↓trắng → Kết tủa tan trong NaHSO4 dư.
X không thể là NaOH và NaHCO3 → Không tạo kết tủa trắng.
Chất X trong dung dịch là BaCl2.
PTHH: BaCl2 + NaHSO4 → NaCl + BaSO4↓trắng + HCl.
Câu 3:
Trong các dung dịch sau: metylamin, anilin, etyl axetat, lysin, số dung dịch làm đổi màu quỳ tím là
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Dung dịch mang tính axit làm quỳ tím hóa đỏ và dung dịch mang tính axit làm quỳ tím hóa xanh.
Giải chi tiết:
Các dung dịch làm đổi màu quỳ tím là metylamin và lysin (hai dung dịch mang tính bazơ làm quỳ tím hóa xanh).
Câu 4:
Cho phản ứng của sắt (Fe) với oxi (O2) như hình vẽ bên:
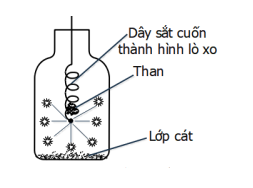
Cho các phát biểu sau:
(1) Sản phẩm của phản ứng là Fe2O3.
(2) Khi đưa vào lọ chứa oxi, dây thép cháy trong oxi sáng chói, nhiều hạt nhỏ sáng bắn tóe như pháo hoa.
(3) Nước trong bình có vai trò là chất xúc tác để cho phản ứng xảy ra nhanh hơn.
(4) Mẩu than gỗ có tác dụng làm mồi vì khi than cháy, tỏa nhiệt lượng đủ lớn để phản ứng giữa Fe và O2 xảy ra (có thể thay mẩu than bằng que diêm).
(5). Cần làm sạch và uốn sợi dây thép thành hình lò xo để tăng diện tích tiếp xúc, phản ứng xảy ra nhanh hơn.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Dựa vào lý thuyết tổng hợp về thí nghiệm phản ứng đốt cháy sắt trong oxi.
Giải chi tiết:
(1) sai vì sản phẩm của phản ứng là Fe3O4.
PTHH: 3Fe + 2O2 Fe3O4.
(3) sai vì nước trong bình có vai trò tránh vỡ bình vì phản ứng tỏa nhiều nhiệt.
(2), (4), (5) đúng.
Câu 5:
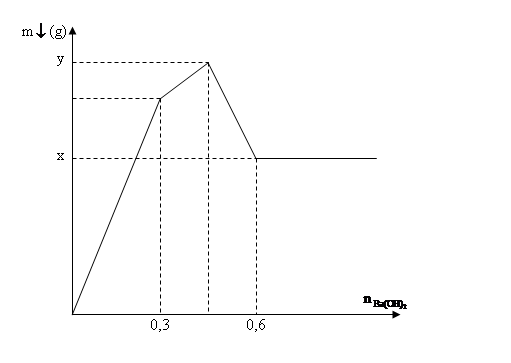
Tổng giá trị (a + b) bằng
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Xét tại hai thời điểm nBa(OH)2 = 0,45 (mol) và nBa(OH)2 = 0,75 (mol).
* Tại thời điểm nBa(OH)2 = 0,45 (mol): Ba(OH)2 kết tủa vừa đủ với Al2(SO4)3
* Tại thời điểm nBa(OH)2 = 0,75 (mol): Kết tủa chỉ còn lại BaSO4 0,45 (mol), toàn bộ kết tủa Al(OH)3 bị tan hết.
* a là khối lượng của BaSO4 và b là khối lượng của BaSO4 và Al(OH)3 (max).
Giải chi tiết:
* Tại thời điểm nBa(OH)2 = 0,45 (mol): Ba(OH)2 kết tủa vừa đủ với Al2(SO4)3
⟹ nBaSO4 = nBa(OH)2 = 0,45 (mol).
⟹ nAl(OH)3 = (2nBa(OH)2)/3 = 0,3 (mol).
Bảo toàn nguyên tố Al ⟹ nAl2(SO4)3 = nAl(OH)3/2 = 0,15 (mol).
* Tại thời điểm nBa(OH)2 = 0,75 (mol): Kết tủa chỉ còn lại BaSO4 0,45 (mol), toàn bộ kết tủa Al(OH)3 bị tan hết.
⟹ a = mBaSO4 = 0,45.233 = 104,85 (g).
Vì kết tủa Al(OH)3 tan hết ⟹ 4nAl3+ = nOH- = 0,75.2 = 1,5 (mol) ⟹ nAl3+ = 0,375 (mol).
⟹ nAl(OH)3 (max) = nAl3+ = 0,375 (mol).
* Khối lượng kết tủa đạt cực đại (max) là b = mBaSO4 + mAl(OH)3 (max) = 104,85 + 0,375.78 = 134,1 (g).
Vậy a + b = 104,85 + 134,1 = 238,95 (g).
Câu 6:
Trong công nghiệp, kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy oxit tương ứng?
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào lý thuyết về điều chế kim loại trong công nghiệp.
Giải chi tiết:
Trong công nghiệp, kim loại Al được điều chế bằng phương pháp điện phân nóng chảy oxit tương ứng.
PTHH: 2Al2O3 4Al + 3O2.
Câu 7:
Có ba dung dịch riêng biệt: H2SO4 1M; Al2(SO4)3 1M; AlCl3 1M được đánh số ngẫu nhiên là (1), (2), (3). Tiến hành các thí nghiệm sau:
TN1: Trộn V (ml) (1) với V ml (2) và 3V ml dung dịch NaOH 1M thu được a mol kết tủa.
TN2: Trộn V (ml) (1) với V ml (2) và 3V ml dung dịch Ba(OH)2 1M thu được 5a mol kết tủa.
TN3: Trộn V (ml) (2) với V ml (3) và 4V ml dung dịch Ba(OH)2 1M thu được b mol kết tủa.
Biết các phản ứng xảy ra hoàn toàn. So sánh nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào thí nghiệm 1 và 2 ⟹ (1), (2), (3) lần lượt là dung dịch nào?
* TH1: (1) và (2) là H2SO4 và Al2(SO4)3.
* TH2: (1) và (2) là H2SO4 và AlCl3.
* TH3: (1) và (2) là AlCl3 và Al2(SO4)3.
Dựa vào thí nghiệm 3 ⟹ Phương trình liên hệ giữa a và b.
Giải chi tiết:
Giả sử V = 1000ml = 1 lít.
* TH1: (1) và (2) là H2SO4 và Al2(SO4)3.
1 mol H2SO4 + 1 mol Al2(SO4)3 + 3 mol NaOH → 1/3 mol Al(OH)3 ⟹ 1/3 mol kết tủa.
1 mol H2SO4 + 1 mol Al2(SO4)3 + 3 mol Ba(OH)2 → 4/3 mol Al(OH)3 và 3 mol BaSO4 ⟹ 13/3 mol kết tủa
⟹ Loại
* TH2: (1) và (2) là H2SO4 và AlCl3
1 mol H2SO4 + 1 mol AlCl3 + 3 mol NaOH → 1/3 mol Al(OH)3 ⟹ 1/3 mol kết tủa.
1 mol H2SO4 + 1 mol AlCl3 + 3 mol Ba(OH)2 → 1 mol BaSO4 ⟹ 1 mol kết tủa.
⟹ Loại
* TH3: (1) và (2) là AlCl3 và Al2(SO4)3
1 mol AlCl3 + 1 mol Al2(SO4)3 + 3 mol NaOH → 1 mol Al(OH)3 ⟹ 1 mol kết tủa.
1 mol AlCl3 + 1 mol Al2(SO4)3 + 3 mol Ba(OH)2 → 3 mol BaSO4 và 2 mol Al(OH)3 ⟹ 5 mol kết tủa.
⟹ Thỏa mãn.
Vậy (1) là AlCl3, (2) là Al2(SO4)3, (3) là H2SO4
* Xét TN3:
1 mol Al2(SO4)3 + 1 mol H2SO4 + 4 mol Ba(OH)2 → 4 mol BaSO4 và 2 mol Al(OH)3 ⟹ 6 mol kết tủa.
Vậy b = 6a
Câu 8:
Cho 1 mol triglixerit X tác dụng với dung dịch NaOH dư thu được 1 mol glixerol, 1 mol natri panmitat và 2 mol natri oleat. Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
X + 3NaOH → C3H5(OH)3 + C15H31COONa + 2C17H33COONa
⟹ CTCT của X.
Xét các nhận xét ⟹ Nhận xét sai.
Giải chi tiết:
X + 3NaOH → C3H5(OH)3 + C15H31COONa + 2C17H33COONa
⟹ X được tạo bởi 2 axit oleic, 1 axit panmitic và glixerol.
Xét các nhận xét:
(A) đúng vì X có 2 liên kết đôi trong 2 axit oleic ⟹ 1 mol X phản ứng được với tối đa 2 mol Br2.
(B) sai vì công thức phân tử của X là C55H102O6.
(C) đúng. Hai công thức cấu tạo phù hợp của X là
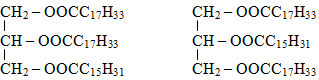
(D) đúng vì X có 2 liên kết π trong axit oleic và 3 liên kết π trong –COO–.
Câu 9:
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào công thức cấu tạo và tính chất hóa học của các hợp chất trong dãy khi phản ứng với NaOH.
Giải chi tiết:
(1) CH3COOC6H5 + 2NaOH → CH3COONa + C6H5ONa+ H2O
(2) CH3NH3Cl + NaOH → CH3NH2 + NaCl + H2O
(3) [H2NCHCH2 CH2](COOH)2 + 2NaOH → [H2NCHCH2 CH2](COONa)2 + 2H2O
(4) H2NCH2CO-HNCH(CH3)COOH + 2NaOH → H2NCH2COONa + H2NCH(CH3)COONa + 2H2O
Vậy các chất trong dãy tác dụng với NaOH đun nóng tỉ lệ 1 : 2 là (1), (3) và (4).
Câu 10:
Chất nào sau đây thuộc loại đisaccarit?
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Dựa vào lý thuyết tổng hợp về cacbohiđrat.
Giải chi tiết:
Saccarozơ (C12H22O11) thuộc loại đisaccarit.
Câu 11:
Cho các hợp kim Fe – Cu; Fe – C; Zn – Fe; Mg – Fe tiếp xúc với không khí ẩm. Số hợp kim trong đó Fe bị ăn mòn điện hóa là
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Trong không khí ẩm, hợp kim xảy ra ăn mòn điện hóa, kim loại nào có tính khử mạnh hơn sẽ đóng vai trò anot (cực âm) và bị oxi hóa (bị ăn mòn).
Giải chi tiết:
Các hợp kim Fe – Cu và Fe – C (Fe có tính khử mạnh hơn) khi tiếp xúc với không khí ẩm, Fe bị ăn mòn điện hóa.
Câu 12:
Cho hình vẽ mô tả thí nghiệm phân tích định tính hợp chất hữu cơ sau:
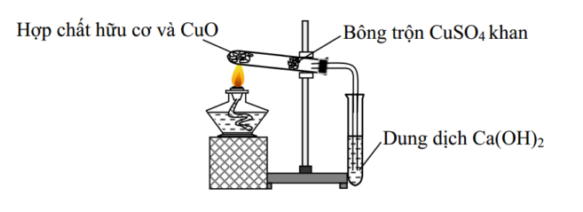
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Dựa vào lý thuyết về phân tích định tính hợp chất hữu cơ.
Giải chi tiết:
Khi thực hiện thí nghiệm phân tích định tính, CuSO4 (khan) có vai trò xác định nguyên tố H trong hợp chất hữu cơ với sự biến đổi màu sắc từ màu trắng (CuSO4 khan) sang màu xanh (CuSO4.5H2O).
Câu 13:
Cho m gam hỗn hợp X gồm CH3OH, C2H4(OH)2, CH2 = CH – CH2OH, CH3CH2OH, C3H5(OH)3 tác dụng với lượng vừa đủ Na thu được 2,016 lít H2 (đktc). Mặt khác, đốt cháy hoàn toàn m gam X cần 12,32 lít O2 (đktc), thu được CO2 và 8,64 gam H2O. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
X có nhóm –OH + Na → –ONa + 0,5H2
⟹ nOH(X) = 2nH2
X + O2 → CO2 + H2O
Sử dụng bảo toàn nguyên tố và bảo toàn khối lượng ⟹ m.
Giải chi tiết:
X có nhóm –OH + Na → –ONa + 0,5H2
⟹ nOH(X) = 2nH2 = 2.0,09 = 0,18 (mol)
X + O2 → CO2 + H2O
BTNT O ⟹ nO(X) + 2nO2 = 2nCO2 + nH2O
⟹ nCO2 = (0,18 + 2.0,55 – 0,48)/2 = 0,4 (mol)
Bảo toàn khối lượng ⟹ mX + mO2 = mCO2 + mH2O
Vậy m = mX = mCO2 + mH2O – mO2 = 8,64 (g).
Câu 14:
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào lý thuyết về hợp chất kiềm.
Giải chi tiết:
Công thức hóa học của kali nitrat là KNO3Câu 15:
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Dựa vào lý thuyết về phương pháp làm mất tính cứng của nước cứng vĩnh cửu.
Giải chi tiết:
Na2CO3 có thể làm mất tính cứng của nước cứng vĩnh cửu.
Ca2+ + CO32- → CaCO3↓
Mg2+ + CO32- → MgCO3↓
Câu 16:
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Dựa và tính chất hóa học của các chất trong dãy và tính chất hóa học của NaOH.
Giải chi tiết:
Các chất phản ứng được với dung dịch NaOH là NaHCO3, Ca(HCO3)2, FeCl3, AlCl3.
PTHH:
NaOH + NaHCO3 → Na2CO3 + H2O
2NaOH + Ca(HCO3)2 → Na2CO3 + CaCO3↓ + 2H2O
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
Al(OH)3 + NaOH → NaAlO2 + 2H2O
Câu 17:
Cho các phát biểu sau:
(a) Dung dịch I2 làm hồ tinh bột chuyển sang màu xanh tím.
(b) Các este đều nhẹ hơn H2O và tan tốt trong nước.
(c) Tơ xenlulozơ axetat được sản xuất từ xenlulozơ.
(d) Tất cả các peptit đều có phản ứng với Cu(OH)2 tạo hợp chất màu tím.
(e) Alanin dễ tan trong nước và có nhiệt độ nóng chảy cao.
(f) Hợp chất hữu cơ nhất thiết phải có cacbon và hiđro.
Số phát biểu đúng trong các phát biểu trên là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào kiến thức lý thuyết tổng hợp về chương 1,2,3,4 – Hóa học 12.
Giải chi tiết:
(b) sai vì este không tan trong nước.
(d) sai vì chỉ peptit chứa từ 2 liên kết peptit trở lên mới có phản ứng với Cu(OH)2 tạo hợp chất màu tím.
(f) sai vì hợp chất hữu cơ nhất thiết phải có cacbon, hiđro có thể có hoặc không.
(a), (c), (e) đúng.
Câu 18:
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Dựa vào tính chất hóa học của Al.
Giải chi tiết:
Al không tan trong dung dịch NH3.
Câu 19:
Cho 0,1 mol este X (no, đơn chức, mạch hở) phản ứng hoàn toàn với dung dịch chứa 0,18 mol MOH (M là kim loại kiềm). Cô cạn dung dịch sau phản ứng thu được chất rắn Y và 4,6 gam ancol Z. Đốt cháy hoàn toàn Y, thu được M2CO3, H2O và 4,84 gam CO2. Tên gọi của X là
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Gọi công thức phân tử của este X là CnH2n+1COOCmH2m+1 (n ≥ 0 và m ≥ 1); n, m ∈ N*)
X + MOH → muối + ancol (MOH dư).
⟹ nZ = nmuối = nMOH(pứ) = nX ⟹ m.
Y gồm MOH dư và muối + O2 → CO2 + H2O
Sử dụng bảo toàn nguyên tố M và C ⟹ n ⟹ CTPT của X.
Giải chi tiết:
* Gọi công thức phân tử của este X là CnH2n+1COOCmH2m+1 (n ≥ 0 và m ≥ 1); n, m ∈ N*)
CnH2n+1COOCmH2m+1 + MOH → CnH2n+1COOM + CmH2m+1OH
0,1 → 0,1 0,1 0,1 (mol)
⟹ MZ = Mancol = 14m + 18 = 4,6/0,1 = 46 ⟹ m = 2.
* Y gồm MOH dư 0,08 (mol) và CnH2n+1COOM 0,1 (mol)
Y + O2 M2CO3 + CO2 + H2O
+ BTNT M ⟹ nM2CO3 = (nMOH + nmuối)/2 = 0,09 (mol).
+ BTNT C ⟹ (n + 1)nmuối = nM2CO3 + nCO2 = 0,2 ⟹ n = 1.
Vậy CTPT của X là CH3COOC2H5 (etyl axetat).
Câu 20:
Cho sơ đồ chuyển hóa sau: Tinh bột → X → Y → Axit axetic. Chất X và Y lần lượt là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Dựa vào tính chất hóa học của tinh bột, xác định hợp chất X và Y phù hợp để tạo ra axit axetic.
Giải chi tiết:
(C6H10O5)n → C6H12O6 (glucozơ) → C2H5OH (ancol etylic) → CH3COOH (axit axetic).
(C6H10O5)n + nH2O nC6H12O6
C6H12O6 2C2H5OH + 2CO2
C2H5OH + O2 CH3COOH + H2O
Câu 21:
Thủy phân hoàn toàn este X mạch hở có công thức phân tử là C7H12O4 trong dung dịch NaOH thu được một muối natri cacboxylat và một ancol, hơn kém nhau 1 nguyên tử C. Số đồng phân cấu tạo của X là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Este X được tạo bởi 1 axit và 1 ancol (axit và ancol hơn kém nhau 1 nguyên tử C) và este X no, 2 chức, mạch hở.
* TH1: X được tạo bởi axit no, 2 chức, mạch hở và ancol no, đơn chức, mạch hở.
* TH2: X được tạo bởi ancol no, 2 chức, mạch hở và axit no, đơn chức, mạch hở.
Giải chi tiết:
Este X được tạo bởi 1 axit và 1 ancol (axit và ancol hơn kém nhau 1 nguyên tử C) và este X no, 2 chức, mạch hở.
* TH1: X được tạo bởi axit no, 2 chức, mạch hở và ancol no, đơn chức, mạch hở.
⟹ Axit tạo nên este X là HOOC – CH2 – COOH và ancol tạo nên este là C2H5OH (axit hơn ancol 1 nguyên tử C).
⟹ CTCT của X là C2H5OOC – CH2 – COOC2H5.
* TH2: X được tạo bởi ancol no, 2 chức, mạch hở và axit no, đơn chức, mạch hở.
⟹ Axit tạo nên este X là CH3COOH và ancol tạo nên este là C3H6(OH)2 (ancol hơn axit 1 nguyên tử C).
⟹ CTCT của X là

Vậy số đồng phân cấu tạo phù hợp của X là 3 đồng phân.
Câu 22:
Cho 16,25 gam Zn vào 200ml dung dịch FeSO4 1M, sau phản ứng thu được m gam hỗn hợp kim loại X. Hòa tan m gam X bằng dung dịch HCl dư thấy thoát ra V lít H2 (đktc). Biết các phản ứng xảy ra hoàn toàn. Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
* Xét phản ứng: Zn + FeSO4 → ZnSO4 + Fe
So sánh nZn và nFeSO4 ⟹ chất dư, hết ⟹ Thành phần của X.
* Xét phản ứng: X + HCl → muối + H2
Theo PTHH ⟹ nH2 ⟹ V.
Giải chi tiết:
* Xét phản ứng cho Zn vào dung dịch FeSO4
PTHH: Zn + FeSO4 → ZnSO4 + Fe
0,25 0,2 (mol)
⟹ Sau phản ứng, FeSO4 phản ứng hết và Zn còn dư.
Theo PTHH ⟹ nZn(pứ) = nFe = nFeSO4 = 0,2 (mol)
⟹ nZn(dư) = 0,25 – 0,2 = 0,05 (mol)
Vậy trong X gồm Zn dư 0,05 (mol) và Fe 0,2 (mol).
* Xét phản ứng hòa tan X bằng dung dịch HCl
Zn + 2HCl → ZnCl2 + H2
Fe + 2HCl → FeCl2 + H2
Theo PTHH ⟹ nH2 = nZn + nFe = 0,25 (mol)
Vậy V = 0,25.22,4 = 5,6 (lít).
Câu 23:
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Hợp chất hữu cơ có liên kết đôi → thực hiện phản ứng trùng hợp tạo polime.
Giải chi tiết:
Polime là sản phẩm của phản ứng trùng hợp là polietilen, tơ nitron, poli(vinyl clorua).
nCH2 = CH2 (– CH2 – CH2 –)n (polietilen).
nCH2 = CH – CN (– CH2 – CH(CN) –)n (tơ nitron).
nCH2 = CHCl (– CH2 – CHCl –)n (poli(vinyl clorua)).
Câu 24:
Cho các phương pháp sau:
(a) Gắn kim loại kẽm vào kim loại sắt.
(b) Gắn kim loại đồng vào kim loại sắt.
(c) Phủ một lớp sơn lên bề mặt sắt.
(d) Tráng thiếc lên bề mặt sắt.
Số phương pháp điện hóa được sử dụng để bảo vệ kim loại sắt không bị ăn mòn là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào kiến thức ăn mòn điện hóa.
Giải chi tiết:
Các phương pháp điện hóa được sử dụng để bảo vệ kim loại sắt không bị ăn mòn là (a), (c) và (d).
(b) sai vì Fe có tính khử mạnh hơn Cu, gắn kim loại đồng vào kim loại sắt sẽ khiến sắt bị ăn mòn điện hóa.
Câu 25:
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Dựa vào dãy điện hóa của kim loại để xác định trình tự của các phản ứng xảy ra.
So sánh tỉ lệ các số mol của từng phương trình ⟹ Chất hết, chất dư.
⟹ Thành phần chất rắn thu được sau phản ứng ⟹ m.
Giải chi tiết:
nMg = 0,2 (mol); nFe2+ = 0,1 (mol); nCu2+ = 0,15 (mol).
Mg + Cu2+ → Mg2+ + Cu
0,15 ← 0,15 → 0,15 (mol)
⟹ Sau phản ứng Mg còn dư 0,05 (mol)
Mg + Fe2+ → Mg2+ + Fe
0,05 → 0,05 0,05 (mol)
⟹ Sau phản ứng Fe2+ còn dư 0,05 (mol)
⟹ Chất rắn thu được sau phản ứng gồm 0,15 mol Cu và 0,05 mol Fe.
Vậy m = mCu + mFe = 12,4 (g).
Câu 26:
Poli (vinyl clorua) (PVC) được điều chế từ phản ứng trùng hợp chất nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
PVC được điều chế từ vinylclorua bằng phản ứng trùng hợp.
Giải chi tiết:
nCH2 = CHCl (– CH2 – CHCl –)n (poli(vinyl clorua)).
Câu 27:
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Dựa vào kiến thức tổng hợp về tính chất và ứng dụng của các hợp chất của kim loại kiềm.
Giải chi tiết:
Công thức hóa học của X là CaSO4.H2O (thạch cao nung).
Câu 28:
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Dựa vào kiến thức và cách gọi tên este.
Giải chi tiết:
Công thức của benzyl axetat là CH3COOCH2C6H5.
Câu 29:
Cho 5 gam hỗn hợp X gồm Cu và Fe vào dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn thu được 1,12 lít khí H2 (đktc). Phần trăm khối lượng của Cu trong X là
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
PTHH: Fe + 2HCl → FeCl2 + H2
Theo PTHH ⟹ nFe ⟹ mFe ⟹ mCu ⟹ %mCu.
Giải chi tiết:
PTHH: Fe + 2HCl → FeCl2 + H2
Theo PTHH ⟹ nFe = nH2 = 1,12/22,4 = 0,05 (mol).
⟹ mCu = mX – mFe = 5 – 0,05.56 = 2,2 (g).
Vậy %mCu = (2,2.100%)/5 = 44%.
Câu 30:
Cho các chất sau: glucozơ, fructozơ, saccarozơ, tinh bột, xenlulozơ, axit fomic. Số chất vừa tham gia phản ứng tráng bạc, vừa hòa tan Cu(OH)2 ở nhiệt độ thường là
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Chất vừa tham gia phản ứng tráng bạc có liên kết –CHO trong phân tử và vừa hòa tan Cu(OH)2 ở nhiệt độ thường có các nhóm –OH liền kề hoặc mang tính axit (chứa gốc –COOH).
Giải chi tiết:
Chất vừa tham gia phản ứng tráng bạc, vừa hòa tan Cu(OH)2 ở nhiệt độ thường là glucozơ, fructozơ và axit fomic.
* Glucozơ, fructozơ và axit fomic tham gia phản ứng tráng gương.
* Glucozơ và fructozơ hòa tan Cu(OH)2 tạo phức màu xanh lam (do có nhóm –OH liền kề).
* Axit fomic hòa tan Cu(OH)2 tạo dung dịch màu xanh (phản ứng do mang tính axit chứa gốc –COOH).
Câu 31:
Bảng dưới đây ghi lại hiện tượng khi làm thí nghiệm với các chất sau ở dạng chất lỏng nguyên chất hoặc dung dịch trong nước X, Y, Z, T, G:
|
Mẫu thử |
Thuốc thử |
Hiện tượng |
|
X,T |
Qùy tím |
Qùy tím chuyển sang màu đỏ |
|
G |
Qùy tím |
Qùy tím chuyển sang màu xanh |
|
Z |
Cu(OH)2 |
Tạo dung dịch màu xanh lam |
|
Y,Z,T |
Dung dịch AgNO3/NH3, |
Tạo kết tủa Ag |
Các chất X, Y, Z, T, G lần lượt là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Lý thuyết tổng hợp về axit cacboxylic, este, cacbohiđrat, amin, amino axit.
Giải chi tiết:
- Loại D vì khi đó G là anilin không làm đổi màu quỳ tím.
- Loại B, C vì khi đó T là axit glutamic, không có phản ứng tráng gương.
Câu 32:
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Kim loại trao đổi nhiều electron nhất sẽ thu được nhiều khí H2 nhất.
Giải chi tiết:
Ta thấy kim loại trao đổi nhiều electron nhất sẽ thu được nhiều khí H2 nhất.
Al0 → Al+3 + 3e
Fe0 → Fe+2 + 2e
Zn0 → Zn+2 + 2e
Mg0 → Mg+2 + 2e
⟹ Al sẽ cho lượng H2 nhiều nhất.
Câu 33:
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Bảo toàn nguyên tố N →
Do amin đơn chức nên namin = nN.
Số nguyên tử C =
⟹ CTPT của amin.
Giải chi tiết:
Bảo toàn nguyên tố N →
Do amin đơn chức nên namin = nN = 0,1 mol.
Số nguyên tử C = = = = = 4.
⟹ CTPT của amin là C4H11N.
Câu 34:
Cho các thí nghiệm sau:
(1) Sục khí CO2 từ từ đến dư vào dung dịch chứa Ba(OH)2.
(2) Cho dung dịch Ba(OH)2 dư vào dung dịch chứa phèn chua.
(3) Sục khí NH3 dư vào dung dịch chứa AlCl3.
(4) Cho từ từ dung dịch HCl đến dư vào dung dịch chứa NaAlO2.
(5) Sục khí HCl dư vào dung dịch chứa AgNO3.
(6) Cho từ từ đến dư dung dịch Al(NO3)3 vào dung dịch KOH và khuấy đều.
Số thí nghiệm có kết tủa xuất hiện, sau đó kết tủa tan hết là
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Lý thuyết về hợp chất của kim loại kiềm thổ - nhôm.
Giải chi tiết:
(1) CO2 + Ba(OH)2 → BaCO3 ↓ + H2O
BaCO3 + CO2 + H2O → Ba(HCO3)2
→ thỏa mãn
(2) Hòa tan phèn chua vào nước thu được Al2(SO4)3; K2SO4
→ không thỏa mãn vì kết tủa BaSO4 không tan khi cho dư Ba(OH)2 dư.
(3) 3NH3 + AlCl3 + 3H2O → Al(OH)3 ↓ + 3NH4Cl
→ không thỏa mãn vì Al(OH)3 không tan trong dd NH3 dư.
(4) HCl + NaAlO2 + H2O → Al(OH)3 ↓ + NaCl
3HCl + Al(OH)3 → AlCl3 + 3H2O
→ thỏa mãn
(5) HCl + AgNO3 → AgCl ↓ + HNO3
→ không thỏa mãn vì AgCl không tan khi HCl dư
(6) Ban đầu KOH dư so với Al(NO3)3 nên không hình thành kết tủa.
4KOH + Al(NO3)3 → KAlO2 + 3KNO3 + 2H2O
→ không thỏa mãn
Vậy có 2 thí nghiệm thỏa mãn.
Câu 35:
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
- Tóm tắt sơ đồ phản ứng.
- Vận dụng các định luật: bảo toàn khối lượng, bảo toàn e, bảo toàn nguyên tố để xác định các yếu tố trong sơ đồ.
Giải chi tiết:
Khi cho AgNO3 vào dd Y thu được khí NO → dd Y chứa Fe2+, H+ dư và không có NO3-.
mdd tăng = mhh - mkhí ⟹ mkhí = mhh - mdd tăng = 30,56 - 22,6 = 7,96 gam ⟹ nkhí = 7,96/(9,95.4) = 0,2 mol.
Ta có:
BTNT N → nNH4+ = nHNO3 - nNO - 2nN2O = 0,02 mol.
nH+(dd Y) = 4nNO (lần 2) = 0,12 mol.
+) mhh đầu = 24a + 232b + 0,06.116 = 30,56 (1)
+) Công thức nhanh: nH+ = 8nFe3O4 + 2nFeCO3 + 4nNO (tổng) + 10nNH4+ + 10nN2O
→ c + 0,24 = 8b + 2.0,06 + 4.(0,06 + 0,03) + 10.0,02 + 10.0,08 (2)
+) Áp dụng bảo toàn e: 2nMg + nFe3O4 + nFeCO3 = 3nNO(tổng) + 8nN2O + 8nNH4+ + nAg
→ 2a + b + 0,06 = 3.0,09 + 8.0,08 + 8.0,02 + nAg
→ nAg = 2a + b - 1,01 (mol).
→ m↓ = mAg + mAgCl = 108.(2a + b - 1,01) + 143,5.c = 239,66 (3)
Giải (1) (2) (3) được a = 0,5; b = 0,05; c = 1,64.
→ %mFe3O4 = (0,05.232/30,56).100% = 37,96% gần nhất với 38%.
Câu 36:
Hòa tan hoàn toàn 21,24 gam hỗn hợp gồm muối hiđrocacbonat (X) và muối cacbonat (Y) vào nước thu được 200 ml dung dịch Z. Cho từ từ 200 ml dung dịch KHSO4 0,3M và HCl 0,45M vào 200 ml dung dịch Z, thu được 1,344 lít khí CO2 (đktc) và dung dịch T. Cho dung dịch Ba(OH)2 dư vào T, thu được 49,44 gam kết tủa. Biết (X) là muối của kim loại kiềm. Nhận định nào sau đây là sai?
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Khi cho từ từ H+ vào hỗn hợp {HCO3-, CO32-} lần lượt xảy ra các phản ứng:
H+ + CO32- → HCO3-
H+ + HCO3- → H2O + CO2
Giải chi tiết:
*Cho T + Ba(OH)2 dư:
BTNT S: nBaSO4 = nKHSO4 = 0,06 mol
→ mBaSO4 = 13,98 gam < 49,44 gam → có kết tủa BaCO3.
→ nBaCO3 = (49,44 - 13,98)/197 = 0,18 mol.
*Cho từ từ H+ vào hỗn hợp {HCO3-, CO32-} lần lượt xảy ra các phản ứng:
nH+ = nKHSO4 + nHCl = 0,15 mol; nCO2 = 0,06 mol.
Đặt
H+ + CO32- → HCO3-
b ← b → b (mol)
H+ + HCO3- → H2O + CO2
0,06 ← 0,06 (mol)
+) Do có kết tủa BaCO3 → trong dung dịch T có chứa HCO3- → H+ hết
→ nH+ = b + 0,06 = 0,15 → b = 0,09
+) BTNT C: nHCO3-(bđ) + nCO32-(bđ) = nCO2 + nBaCO3
→ a + 0,09 = 0,06 + 0,18 → a = 0,15
Giả sử hỗn hợp đầu:
→ mhh = 0,15.(A + 61) + .(2B + 60n) = 21,24
→ 0,15A + = 6,69
A là kim loại kiềm nên ta xét các trường hợp A = {7 (Li); 23 (Na); 39 (K)}:
+ Nếu A = 7 (Li) → B = 94n/3 (loại).
+ Nếu A = 23 (Na) → B = 18n → n = 1; B = 18 (NH4+) thỏa mãn.
+ Nếu A = 39 (K) → B = 14n/3 (loại).
Vậy (X) là NaHCO3; (Y) là (NH4)2CO3 ⟹ A sai.
Câu 37:
Hỗn hợp X chứa một ancol đơn chức và một este (đều no, mạch hở). Đốt cháy hoàn toàn 11,52 gam X bằng lượng O2 vừa đủ thu được tổng số mol CO2 và H2O là 0,81 mol. Mặt khác, 11,52 gam X phản ứng vừa đủ với 0,16 mol KOH thu được muối và hai ancol. Cho Na dư vào lượng ancol trên thoát ra 0,095 mol H2. Phần trăm khối lượng của ancol trong X gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Sử dụng các mối liên hệ:
+ Trong phản ứng thủy phân este: nCOO = nOH(ancol do este tạo ra) = nKOH.
+ Trong phản ứng của ancol với Na: nOH(ancol) = 2nH2.
Giải chi tiết:
nCOO = nOH(ancol do este tạo ra) = nKOH = 0,16 mol.
nOH(ancol tổng) = 2nH2 = 0,19 mol → nOH(ancol ban đầu) = 0,19 - 0,16 = 0,03 mol.
Giả sử đốt hỗn hợp X thu được
+) nCO2 + nH2O = x + y = 0,81 (1)
+) BTNT O: nO(X) = 2nCOO + nOH(ancol ban đầu) = 0,35 mol.
BTKL: mX = mC + mH + mO → 12x + 2y + 0,35.16 = 11,52 (2)
Giải (1) (2) được x = 0,43; y = 0,38.
Nhận thấy nCO2 < 3nCOO ⟹ Este đơn chức hoặc este hai chức.
+ TH1: Nếu este đơn chức → neste = 0,16 mol
Hỗn hợp đầu chứa:
→ nCO2 = 0,03n + 0,16m = 0,43 → 3n + 16m = 43 (loại vì không có nghiệm phù hợp).
+ TH2: Nếu este 2 chức → neste = 0,08 mol
Hỗn hợp đầu chứa:
→ nCO2 = 0,03n + 0,08m = 0,43 → 3n + 8m = 43 → n = 1; m = 5 thỏa mãn.
Vậy hỗn hợp đầu chứa: → %mCH4O = 8,33%.
Câu 38:
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Quy đổi peptit tạo bởi các a.a có 1 nhóm NH2, 1 nhóm COOH thành CONH, CH2, H2O (với số mol H2O bằng số mol peptit).
Giải chi tiết:
- Do các peptit được tạo từ Gly và Ala nên quy đổi hỗn hợp peptit thành CONH, CH2, H2O (với số mol H2O bằng số mol peptit).
BTNT N: nN(P) = 2nN2 = 0,2 mol.
+) mhỗn hợp P = 0,2.43 + 14x + 18y = 13,29 (1)
+) BTNT O: 0,2 + y + 2.0,585 = 2(x + 0,2) + (x + y + 0,1) (2)
Giải hệ (1) (2) được x = 0,29 và y = 0,035.
- Giả sử muối chứa:
+) BTNT N: a + b = 0,2 (3)
+) BTNT C: 2a + 3b = nCONH + nCH2 = 0,2 + 0,29 (4)
Giải (3) (4) → a = 0,11; b = 0,09.
→ m1 = 0,11.(75 + 22) = 10,67 gam.
Câu 39:
Điện phân dung dịch chứa 14,28 gam hỗn hợp CuSO4 và NaCl bằng dòng điện một chiều có cường độ 4A (điện cực trơ, có màng ngăn, hiệu suất 100%). Sau thời gian t giây thì ngừng điện phân, thu được dung dịch X (có pH < 7) và 4,48 lít (đktc) hỗn hợp khí thoát ra ở cả hai điện cực, có tỉ khối so với He là 6,2. Bỏ qua sự hoàn tan của khí trong nước và sự bay hơi của nước. Giá trị của t là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Do dung dịch sau phản ứng có pH < 7 nên H2O đã bị điện phân ở anot.
Đặt nCuSO4 = x mol; nNaCl = y mol; ne = z mol → phương trình (1)
Viết các bán phản ứng điện phân tại catot và anot sau đó đặt mol vào các bán phản ứng.
Catot (-):
Cu2+ + 2e → Cu
2H2O + 2e → 2OH- + H2
Anot (+):
2Cl- → Cl2 + 2e
2H2O → 4H+ + O2 + 4e
Từ số mol khí → phương trình (2)
Từ khối lượng khí → phương trình (3)
Giải hệ (1)(2)(3) được x, y, z.
Tính thời gian t theo công thức:
Giải chi tiết:
Do dung dịch sau phản ứng có pH < 7 nên H2O đã bị điện phân ở anot.
Đặt nCuSO4 = x mol; nNaCl = y mol; ne = z mol → 160x + 58,5y = 14,28 (1)
Catot (-):
Cu2+ + 2e → Cu
x → 2x (mol)
2H2O + 2e → 2OH- + H2
(z-2x) → (0,5z-x) (mol)
Anot (+):
2Cl- → Cl2 + 2e
y → 0,5y → y (mol)
2H2O → 4H+ + O2 + 4e
(0,25z-0,25y) ← (z-y) (mol)
nkhí = (0,5z - x) + 0,5y + (0,25z - 0,25y) = 0,2 (2)
mkhí = 2.(0,5z - x) + 71.0,5y + 32.(0,25z - 0,25y) = 0,2.4.6,2 (3)
Giải hệ được x = 0,06; y = 0,08; z = 0,32.
⟹ ne = z = 0,32 mol
⟹ t = = = 7720 giây.
Câu 40:
Đốt cháy hoàn toàn m gam triglixerit X (trung hòa) cần dùng 69,44 lít khí O2 (đktc) thu được khí CO2 và 36,72 gam nước. Đun nóng m gam X trong 150 ml dung dịch NaOH 1M, sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cô cạn dung dịch Y thu được p gam chất rắn khan. Biết m gam X tác dụng vừa đủ với 12,8 gam Br2 trong dung dịch. Giá trị của p là
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
- Khi đốt cháy chất béo ta có công thức tính nhanh: (k là độ bất bão hòa toàn phân tử).
- Khi chất béo tác dụng với Br2: X + (k-3) Br2 → Sản phẩm cộng.
Giải chi tiết:
- Xét phản ứng đốt X:
X: a mol + O2: 3,1 mol → CO2: b mol + H2O: 2,04 mol
Bảo toàn nguyên tố O cho pư cháy → (1)
- Xét phản ứng của X với dd Br2:
Giả sử X có độ bất bão hòa là k → số liên kết π tham gia cộng Br2 là (k-3).
X + (k-3) Br2 → Sản phẩm cộng
a → a(k-3) (mol)
→ nBr2 = a.(k - 3) = 0,08 → k = 0,08/a + 3.
- Khi đốt cháy chất béo ta có công thức tính nhanh: (k là độ bất bão hòa toàn phân tử)
→ (2)
Giải (1)(2) được a = 0,04 và b = 2,2.
BTKL: mX = mCO2 + mH2O - mO2 = 34,32 (g).
- Xét phản ứng của X với NaOH:
X + 3NaOH → Muối + C3H5(OH)3
Dễ thấy NaOH còn dư → nglixerol = nX = 0,04 mol
BTKL: mchất rắn = mX + mNaOH bđ - mglixerol = 34,32 + 0,15.40 - 0,04.92 = 36,64 (g).
