Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (30 đề)
Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (Đề 6)
-
5140 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Chọn B
Câu 2:
 Xem đáp án
Xem đáp án
Chọn D.
Câu 3:
 Xem đáp án
Xem đáp án
Chọn D
Câu 5:
 Xem đáp án
Xem đáp án
Chọn B
và
Số
Số
là
Muối còn lại là
gam.
Câu 6:
Số đồng phân este C4H8O2 tham gia phản ứng tráng gương là
 Xem đáp án
Xem đáp án
Chọn B
Có 2 đồng phân đơn chức, tráng bạc là:
Câu 8:
 Xem đáp án
Xem đáp án
Chọn A
Phải có kim loại dư, Cu2+ hết.
Nếu chỉ Zn phản ứng thì khối lượng chất rằn phải giảm, vô lý. Vậy Zn phản ứng hết, Fe phản ứng 1 phần.
Đặt là số mol Zn, Fe phản ứng và Fe dư
m rắn
Câu 10:
 Xem đáp án
Xem đáp án
Chọn B
X và Y đều tác dụng với dung dịch AgNO3 dư trong NH3 theo tỉ lệ mol 1 : 2.
là và Y là
Dễ thấy X, Y đều có k = số C nên:
Câu 12:
 Xem đáp án
Xem đáp án
Chọn D
Quy đổi Z thành: , CH2 (b mol), H2O (c mol).
và
m muối =
Số N trung bình tỉ lệ mol 1: 1 và Y có 1N nên X có sai.
Nếu Y là Ala thì X có số và số
là Không thỏa mãn giả thiết loại.
Vậy Y là Gly và X là
Kết luận D đúngCâu 13:
Cho hỗn hợp E gồm 0,2 mol chất hữu cơ mạch hở X (C6H13O4N) và 0,3 mol este Y (C4H6O4) hai chức tác dụng hết với dung dịch NaOH vừa đủ, đun nóng. Kết thúc phản ứng, cô cạn dung dịch, thu được hỗn hợp Z gồm hai ancol đơn chức, kế tiếp nhau trong dãy đồng đẳng và a gam hỗn hợp ba muối khan (đều có cùng số cacbon trong phân tử, trong đó có một muối của aminoaxit). Giá trị của a gần nhất với giá trị nào sua đây?
 Xem đáp án
Xem đáp án
Chọn A
Y là
Hai ancol là CH3OH, C2H5OH.
Do các muối khan cùng C nên X là:
Các muối gồm
m muối = 76 gamCâu 14:
Cho các phát biểu sau:
(1) Ở nhiệt độ thường, Cu(OH)2 tan được trong dung dịch glixerol.
(2) Ở nhiệt độ thường, C2H4 phản ứng được với nước brom.
(3) Đốt cháy hoàn toàn CH3COOCH3 thu được số mol CO2 bằng số mol H2O.
(4) Glyxin (H2NCH2COOH) phản ứng được với dung dịch NaOH.
(5) Dung dịch Glucozơ bị khử bởi AgNO3 trong NH3 tạo ra Ag.
(6) Anilin là chất lỏng, không màu, ít tan trong nước, nặng hơn nước. Để lâu trong không khí, anilin có nhuốm màu đen vì bị oxi hoá;
(7) Cao su buna có tính đàn hồi và độ bền tốt hơn cao su thiên nhiên;
(8) Toluen và stiren đều làm mất màu dung dịch thuốc tím ở điều kiện thường.
Số phát biểu đúng là Xem đáp án
Xem đáp án
Chọn D
(1) Đúng, do có các OH kề nhau.
(2) Đúng
(3) Đúng
(4) Đúng
(5) Sai, bị oxi hóa.
(6) Đúng
(7) Sai, cao su thiên nhiên tốt hơn.
(8) Sai, toluen làm mất màu khi đun nóng.Câu 15:
 Xem đáp án
Xem đáp án
Chọn C
Kết tủa lớn nhất nhưng dùng NaOH ít nhất nên:
Bảo toàn
gamCâu 16:
 Xem đáp án
Xem đáp án
Chọn D
Câu 18:
 Xem đáp án
Xem đáp án
Chọn A
Muối gồm
m muối = 59,85 gamCâu 20:
 Xem đáp án
Xem đáp án
Chọn A
Dung dịch Y chứa và dư
Bảo toàn điện tích:
Bảo toàn electron:
và b = 0,13
Quy đổi hỗn hợp thành Fe (0,32 mol), O (u mol) và .
Trong Z, đặt
Bảo toàn N:
pư
Giải hệ
Đặt k, 3h, 2h, h lần lượt là số mol
Bảo toàn
Bảo toàn
Giải hệ và h = 0,01
Số mol hỗn hợp
Câu 22:
Cho các sơ đồ phản ứng:
(1) E + NaOH → X + Y;
(2) F + NaOH → X + Z;
(3) Y + HCl → T + NaCl
Biết E, F đều là các hợp chất hữu cơ no, mạch hở, chỉ chứa nhóm chức este (được tạo thành từ axit cacboxylic và ancol) và trong phân tử có số nguyên tử cacbon bằng số nguyên tử oxi; E và Z có cùng số nguyên tử cacbon; ME < MF < 175.Cho các phát biểu sau:
(a) Nhiệt độ sôi của E thấp hơn nhiệt độ sôi của CH3COOH
(b) Có hai công thức cấu tạo của F thỏa mãn sơ đồ trên.
(c) Hai chất E và T có cùng công thức đơn giản nhất
(d) Đốt cháy hoàn toàn Z, thu được Na2CO3, CO2 và H2O.
(e) Từ X điều chế trực tiếp được CH3COOH.
Số phát biểu không đúng là:
 Xem đáp án
Xem đáp án
Chọn C
E và F có số C bằng số O nên có dạng
Số chức este là 0,5n.
E và F đều no, mạch hở nên
là và F là
là muối natri. Mặt khác, E và Z cùng C nên:
E là H là và Y là HCOONa.
F là là
T là HCOOH.
(a) Đúng
(b) Sai
(c) Sai, CTĐGN của E là của T là CH2O2.
(d) Sai, đốt Z tạo (không tạo H2O).
(e) Đúng:
Câu 23:
Thí nghiệm xác định định tính nguyên tố cacbon và hidro trong phân tử saccarozơ được tiến hành theo các bước sau:
- Bước 1: Trộn đều khoảng 0,2 gam saccarozơ với 1 đến 2 gam đồng (II) oxit, sau đó cho hỗn hợp vào ống nghiệm khô (ống số 1) rồi thêm tiếp khoảng 1 gam đồng (II) oxit để phủ kín hỗn hợp. Nhồi một nhúm bông có rắc bột CuSO4 khan vào phần trên ống số 1, rồi nút bằng nút cao su có ống dẫn khí.
- Bước 2: Lắp ống số 1 lên giá thí nghiệm, rồi nhúng ống dẫn khí vào dung dịch Ca(OH)2 đựng trong ống nghiệm (ống số 2)
- Bước 3: Dùng đèn cồn đun nóng ống số 1 (lúc đầu đun nhẹ, sau đó đun tập trung vào phần có hỗn hợp phản ứng)
Cho các phát biểu sau:
(a) Sau bước 3, màu trắng của CuSO4 khan chuyển thành màu xanh CuSO4.5H2O.
(b) Thí nghiệm trên còn được dùng để xác định định tính nguyên tố oxi trong phân tử saccarozơ.
(c) Dung dịch Ca(OH)2 được dùng để nhận biết CO2 sinh ra trong thí nghiệm trên.
(d) Ở bước 2, lắp ống số 1 sau cho miệng ống hướng lên.
(e) Kết thúc thí nghiệm: tắt đèn cồn, để ống số 1 nguội hẳn rồi mới đưa ống dẫn khí ra khỏi dung dịch trong ống số 2.
Số phát biểu không đúng là
 Xem đáp án
Xem đáp án
Chọn C
(a) Đúng
(b) Sai, thí nghiệm chỉ định tính được C và H trong saccarozơ.
(c) Đúng, được phát hiện thông qua sự vẩn đục của dung dịch Ca(OH)2.
(d) Sai, lắp sao cho miệng ống hơi cúi xuống (thấp hơn đáy ống), mục đích là làm cho nước bám vào thành ống nghiệm (CuSO4 khan có thể không hấp thụ hết) không chảy ngược xuống đáy ống nghiệm (gây vỡ ống).
(e) Sai, tháo ống dẫn khí trước rồi mới tắt đèn cồn. Nếu làm ngược lại, khi tắt đèn cồn trước, nhiệt độ ống 1 giảm làm áp suất giảm, nước có thể bị hút từ ống 2 lên ống 1, gây nguy cơ vỡ ống 1Câu 24:
 Xem đáp án
Xem đáp án
Chọn C
Câu 25:
 Xem đáp án
Xem đáp án
Chọn C
0,09…….0,27
lít
Câu 27:
 Xem đáp án
Xem đáp án
Chọn B
m tăng
gam
Câu 28:
 Xem đáp án
Xem đáp án
Chọn D
là este no, đơn chức, mạch hở
Số X là C3H6O2
Chất rắn gồm và KOH dư (0,04)
m rắn
X là là CH3OH
Câu 31:
 Xem đáp án
Xem đáp án
Chọn A
Bảo toàn electron:
m muối gam.
Câu 32:
 Xem đáp án
Xem đáp án
Chọn D
Câu 33:
Thêm từ từ 100 ml dung dịch HCl 0,5M vào 200 ml dung dịch Na2CO3 0,2M, thu được dung dịch X và V lít khí CO2 (đktc). Cho X tác dụng dung dịch Ba(OH)2 dư thu được m gam kết tủa. Giá trị của V và m lần lượt là:
 Xem đáp án
Xem đáp án
Chọn D
gam
Câu 35:
 Xem đáp án
Xem đáp án
Chọn B
Bảo toàn khối lượng
Z có dạng
và Ancol là
(muối) Muối gồm HCOONa (a) và (COONa)2 (b)
m muối
và b = 0,03
X là HCOOC2H5 (0,04) và Y là
.
Câu 37:
 Xem đáp án
Xem đáp án
Chọn A
dư
Dung dịch thu được chứa và dưCâu 38:
 Xem đáp án
Xem đáp án
Chọn A
và
dư dư = 0,04
trong 200 ml
gam.
Câu 39:
Cho các phát biểu sau:
(1) Tất cả các nguyên tố kim loại đều là chất rắn ở điều kiện thường.
(2) Để xử lí thủy ngân bị rơi vãi người ta dùng bột lưu huỳnh.
(3) Tính dẫn điện của Ag > Cu > Au > Al > Fe.
(4) Cho Mg tác dụng với dung dịch FeCl3 dư thu được Fe.
(5). Khi cho Na dư vào dung dịch CuSO4 thấy có khí thoát ra, đồng thời thu được kết tủa màu xanh.
Số phát biểu không đúng là Xem đáp án
Xem đáp án
Chọn C
(1) Sai, Hg là chất lỏng điều kiện thường.
(2) Đúng
(3) Đúng
(4) Sai, dư
(5) Đúng:
Câu 40:
Khi nhúng thanh Mg có khối lượng m gam vào dung dịch hỗn hợp X chứa a mol Cu(NO3)2 và b mol HCl, ta có đồ thị biểu diễn sự phụ thuộc của khối lượng Mg vào thời gian phản ứng được biểu diễn như hình vẽ dưới đây:
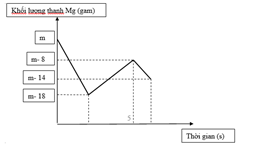
Sau khi phản ứng xảy ra hoàn toàn rút thanh Mg ra, thu được khí NO là sản phẩm khử duy nhất của N+5. Tỉ lệ a : b là:
 Xem đáp án
Xem đáp án
Chọn C
Đoạn 1: Khối lượng Mg giản 18 gam (0,75 mol)
Đoạn 2: Khối lượng Mg tăng gam
Đoạn 3: Khối lượng Mg giảm gam (0,25 mol)
Vậy
