Tuyển tập 20 bộ đề thi thử THPTQG Hóa Học cực hay có lời giải
Tuyển tập 20 bộ đề thi thử THPTQG Hóa Học cực hay có lời giải (Đề số 14)
-
3046 lượt thi
-
39 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Một mẫu nước cứng chứa các ion: Mg2+; Ca2+; Cl-; SO42-. Chất được dùng để làm mềm mẫu nước cứng trên là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 2:
Cho các chất: C2H5OH; CH3COOH; C2H2; C2H4. Có bao nhiêu chất sinh ra từ CH3CHO bằng một phản ứng?
 Xem đáp án
Xem đáp án
Đáp án D
Câu 8:
Dung dịch HCl có thể phản ứng với tất cả các ion hay các chất rắn nào dưới đây?
 Xem đáp án
Xem đáp án
Chọn C
Câu 9:
Khi thủy phân hợp chất hữu cơ X (không có phản ứng tráng bạc) trong môi trường axit rồi trung hòa axit thì dung dịch thu được dung dịch có phản ứng tráng bạc. X là
 Xem đáp án
Xem đáp án
Chọn C
Câu 10:
Chất nào sau đây tác dụng với lượng dư dung dịch Ba(OH)2 tạo thành kết tủa sau phản ứng?
 Xem đáp án
Xem đáp án
Chọn B
Câu 13:
Khi làm bay hơi 8,14 gam một este đơn chức X thu được một thể tích đúng bằng thể tích của 3,52 gam oxi đo ở cùng điều kiện nhiệt độ và áp suất. Công thức phân tử của X là
 Xem đáp án
Xem đáp án
Chọn B
Câu 14:
Cho 0,1 mol FeCl3 phản ứng hoàn toàn với dung dịch AgNO3 dư thu được m gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn C
Câu 15:
Cho m gam Na và Al vào nước dư thu được 4,48 lít khí H2 (ở đktc). Mặt khác, cho m gam hỗn hợp trên tác dụng với dung dịch NaOH dư thu được 11,2 lít khí H2 (đktc). Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn B
Câu 16:
Lên men hoàn toàn a gam glucozơ thu được C2H5OH và CO2. Hấp thụ hết CO2 sinh ra vào dung dịch nước vôi trong dư thu được 15 gam kết tủa. Giá trị của a là
 Xem đáp án
Xem đáp án
Chọn C
Câu 17:
Cho hình vẽ mô tả thí nghiệm điều chế khí Y từ chất rắn X như sau:
Hình vẽ trên minh họa cho phản ứng nào sau đây?
 Xem đáp án
Xem đáp án
Chọn B
Câu 21:
Đốt cháy hoàn toàn 4,03 gam triglixerit X bằng một lượng O2 vừa đủ, cho toàn bộ sản phẩm cháy hấp thụ hết vào bình đựng nước vôi trong dư thu được 25,5 gam kết tủa và khối lượng dung dịch thu được giảm 9,87 gam so với dung dịch nước vôi trong ban đầu. Mặt khác, thủy phân hoàn toàn 8,06 gam X trong dung dịch NaOH dư đun nóng, thu được dung dịch chứa a gam muối. Giá trị của a là
 Xem đáp án
Xem đáp án
Chọn A.
Ta có: ![]()
![]()
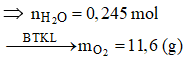
![]()
Khi cho 8,06 gam X tác dụng với NaOH thì: ![]()
Câu 22:
Cho các thí nghiệm sau:
(a) Cho Ba vào dung dịch chứa phèn chua.
(b) Cho FeCl2 vào dung dịch AgNO3.
(c) Cho Ca(OH)2 vào dung dịch chứa Mg(HCO3)2.
(d) Sục khí NH3 vào dung dịch chứa hỗn hợp CuCl2 và AlCl3.
(e) Cho miếng nhôm vào dung dịch NaOH dư rồi sau đó sục khí CO2 vào.
Tồng số thí nghiệm có khả năng tạo hỗn hợp các chất kết tủa là
 Xem đáp án
Xem đáp án
Chọn D.
(a) Hỗn hợp kết tủa gồm BaSO4 và Al(OH)3 (dùng lượng vừa đủ).
(b) Hỗn hợp kết tủa gồm AgCl và Ag.
(c) Hỗn hợp kết tủa gồm CaCO3 và MgCO3.
(d) Hỗn hợp kết tủa gồm Cu(OH)2 và Al(OH)3 (dùng lượng vừa đủ).
(e) Kết tủa thu được là Al(OH)3.
Câu 23:
Cho hỗn hợp Na2CO3 và KHCO3 (tỉ lệ mol tương ứng là 2 : 1) vào bình chứa dung dịch Ba(HCO3)2 thu được m gam kết tủa X và dung dịch Y. Thêm tiếp dung dịch HCl 1M vào bình đến khi không còn khí thoát ra thì hết 320 ml. Biết Y phản ứng vừa đủ với 160 ml dung dịch NaOH 1M. Gá trị của m là
 Xem đáp án
Xem đáp án
Chọn D.
Đặt ![]() và Ba(HCO3)2: b mol.
và Ba(HCO3)2: b mol.
Khi cho Y tác dụng với NaOH thì: a + 2b = 0,16 (1)
Khi cho HCl vào bình thì: 4a + a + 2b = 0,32 (2)
Từ (1), (2) suy ra: a = 0,04; b = 0,06 Þ ![]()
Câu 24:
Tiến hành các thí nghiệm sau:
(1) Ngâm lá Cu trong dung dịch AgNO3.
(2) Ngâm lá Zn trong dung dịch HCl loãng.
(3) Ngâm lá Al trong dung dịch NaOH.
(4) Ngâm lá sắt được cuốn bởi dây đồng trong dung dịch HCl.
(5) Để một vật bằng gang ngoài không khí ẩm.
(6) Ngâm một miếng đồng vào dung dịch Fe2(SO4)3.
Số thí nghiệm xảy ra ăn mòn điện hóa là
 Xem đáp án
Xem đáp án
Chọn D.
Thí nghiệm xảy ra ăn mòn điện hóa là (1), (4), (5).
Câu 25:
Chất rắn màu lục, tan trong dung dịch HCl thu được dung dịch A. Cho A tác dụng với hỗn hợp NaOH và Br2 thu được dung dịch màu vàng, cho H2SO4 vào dung dịch A, thấy dung dịch chuyển sang màu da cam. Chất rắn đó là
 Xem đáp án
Xem đáp án
Chọn B.
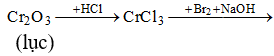
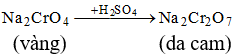
Câu 26:
Tiến hành các thí nghiệm sau:
a. Cho Mg vào dung dịch Fe2(SO4)3 dư.
b. Suc khi H2S vào dung dịch FeCl3.
c. Cho FeS tác dụng với dung dịch HCl.
d. Cho dung dịch AgNO3 vào dung dịch HCl.
e. Cho tinh thể NaNO2 vào dung dịch NH4Cl bão hòa, đun nóng.
Số thí nghiệm không sinh ra đơn chất khí là
 Xem đáp án
Xem đáp án
Chọn B.
Chỉ có thí nghiệm (e) sinh ra đơn chất khí.
(e) NaNO2 + NH4Cl NaCl + N2 + 2H2O.
Câu 27:
Cho dãy các chất sau: propin, but-2-in, axit fomic, axit axetic, anđehit acrylic, saccarozơ, glucozơ, etyl fomat, metyl axetat. Số chất tác dụng với dung dịch AgNO3/NH3 tạo kết tủa là
 Xem đáp án
Xem đáp án
Chọn C.
Chất tác dụng với dung dịch AgNO3/NH3 tạo kết tủa là propin, axit fomic, anđehit acrylic, glucozơ, etyl fomat.
Câu 28:
Khi xà phòng hoá trieste X bằng dung dịch NaOH dư, đun nóng, thu được sản phẩm gồm glixerol, natri fomat, natri axetat, và natri acrylat. Số đồng phân cấu tạo thỏa mãn tính chất của X là
 Xem đáp án
Xem đáp án
Chọn D.
Các đồng phân thoả mãn của X là R1R2R3, R1R3R2, R2R1R3 (với R1, R2, R3 là các gốc muối).
Câu 29:
Hợp chất X có công thức phân tử C6H8O6. X phản ứng với dung dịch NaOH theo tỉ lệ 1 : 3 và phản ứng với dung dịch AgNO3/NH3 theo tỉ lệ 1 : 6, X không phản ứng với NaHCO3. Có các kết luận sau:
(1) X tham gia phản ứng thủy phân. (2) X có chứa nhóm chức axit cacboxylic.
(3) X có chứa nhóm este. (4) X có phản ứng với Na.
(5) X là hợp chất hữu cơ đa chức. (6) X chứa liên kết ba đầu mạch.
Số kết luận đúng về X là
 Xem đáp án
Xem đáp án
Chọn A.
Theo đề ta suy ra CTCT của X là (HCOO)3C3H5
(2) Sai, X không có chứa nhóm chức axit cacboxylic.
(4) Sai, X không phản ứng với Na.
(6) Sai, X không có liên kết ba.
Câu 30:
Đốt cháy hoàn toàn m gam hiđrocacbon ở thể khí, nhẹ hơn không khí, mạch hở thu đươc 7,04 gam CO2. Sục m gam hiđrocacbon này vào nước brom dư đến phản ứng hoàn toàn, thấy có 25,6 gam brom phản ứng. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn B.
Nhận thấy 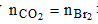 Þ Số liên kết pi bằng số nguyên tử cacbon.
Þ Số liên kết pi bằng số nguyên tử cacbon.
Mà hiđrocacbon nhẹ hơn không khí (M < 29) Þ Hiđrocacbon đó là C2H2 có m = 2,08 (g).
Câu 31:
Cho các phát biểu sau:
(a) Đun nóng dung dịch sacarozơ trong môi trường axit chỉ thu được glucozơ.
(b) Nhỏ dung dịch brom vào dung dịch phenol lấy dư thấy xuất hiện kết tủa màu trắng.
(c) Để làm sạch lọ đựng anilin thì rửa bằng dung dịch HCl sau đó rửa lại bằng nước.
(d) Có thể sử dụng Cu(OH)2 để phân biệt hai dung dịch Gly-Gly và Gly-Ala-Ala.
(e) Có 2 chất trong các chất: phenol, etyl axetat, ancol etylic, axit axetic tác dụng được với dung dịch NaOH.
(g) Dầu thực vật và dầu bôi trơn có thành phần chính là chất béo.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn A.
(a) Sai, Đun nóng dung dịch sacarozơ trong môi trường axit thu được glucozơ và fructozơ.
(e) Sai, Có 3 chất tác dụng với NaOH phenol, etyl axetat, axit axetic.
(g) Sai, Dầu bôi trơn có thành phần chính là hiđrocacbon.
Câu 32:
X, Y, Z là ba axit cacboxylic đơn chức cùng dãy đồng đẳng (MX < MY < MZ), T là este tạo bởi X, Y, Z với một ancol no, ba chức, mạch hở E. Đốt cháy hoàn toàn 26,6 gam hỗn hợp M gồm X, Y, Z, T (trong đó Y và Z có cùng số mol) bằng lượng vừa đủ khí O2, thu được 22,4 lít CO2 (đktc) và 16,2 gam H2O. Mặt khác, đun nóng 26,6 gam M với lượng dư dung dịch AgNO3/NH3, sau khi các phản ứng xảy ra hoàn toàn, thu được 21,6 gam Ag. Mặt khác, cho 13,3 gam M phản ứng hết với 400 ml dung dịch NaOH 1M và đun nóng, thu được dịch N. Cô cạn dung dịch N thu được m gam chất rắn khan. Giá trị của m gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Chọn A.
- Đun nóng M thu được Ag suy ra trong M có HCOOH, vậy các axit thuộc dãy đồng đẳng của HCOOH.
- Đốt cháy: ![]()
![]()
![]()
![]()
![]()
![]()
![]()
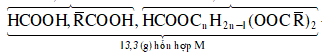
![]()
![]()
![]()
![]()
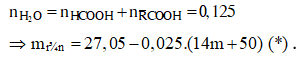
Ta có: ![]()
Câu 33:
Hỗn hợp X gồm 2 este đơn chức. Cho 0,05 mol X tác dụng vừa đủ với dung dịch NaOH thu được hỗn hợp sản phẩm hữu cơ Y. Đốt cháy hoàn toàn Y thu được 2,688 lít CO2 (đktc) và 3,18 gam Na2CO3. Khi làm bay hơi Y thu được x gam chất rắn. Giá trị của x là
 Xem đáp án
Xem đáp án
Chọn A.
Ta có: ![]()
![]()
=> Trong X có 1 este của phenol (A) và 1este của ancol (B) với ![]()
![]()
![]()
![]()
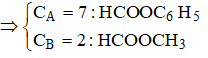
Chất rắn thu được là HCOONa (0,05 mol) và C6H5ONa (0,01 mol) Þ mrắn = 4,56 (g).
Câu 34:
Cho m gam Zn vào 200 ml dung dịch CuSO4 1M và Fe2(SO4)3 0,5M, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch X có khối lượng tăng lên 6,62 gam. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn C.
Các phản ứng xảy ra:
Zn + Fe2(SO4)3 ® ZnSO4 + 2FeSO4 , Dmgiảm 1 = 0,1.65 = 6,5 (g)
Zn + CuSO4 ® ZnSO4 + CuSO4 , Dmgiảm 2 = (65 – 64).0,2 = 0,2 (g)
Nhận thấy: Dmgiảm 1 + Dmgiảm 2 > 6,62 Þ Dmgiảm 2 thực tế = 6,62 – 6,5 = 0,12 (g)
Vậy nZn = 0,12 + 0,1 = 0,22 mol Þ mZn = 14,3 (g).
Câu 35:
Sục CO2 vào 200 gam dung dịch Ca(OH)2, kết quả thí nghiệm được biểu diễn bằng đồ thị sau:
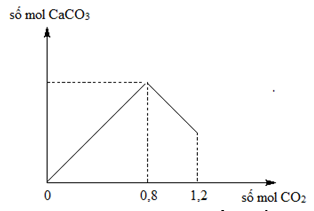
Nồng độ phần trăm chất tan sau phản ứng tại thời điểm số mol CO2 bằng 1,2 là
 Xem đáp án
Xem đáp án
Chọn A.
Tại ![]()
Tại ![]()
![]()
Ta có: mdd sau pư ![]()
![]()
Câu 36:
Hỗn hợp X gồm 2 chất Y (C2H8N2O4) và chất Z (C4H8N2O3); trong đó Y là muối của axit hữu cơ đa chức, Z là đipeptit mạch hở. Cho 25,6 gam X tác dụng với dung dịch NaOH dư, đun nóng thu được 0,2 mol khí. Mặt khác, cho 25,6 gam X tác dụng với dung dịch HCl dư, thu được m gam chất hữu cơ. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn B.
Ta có: 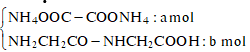
![]()
Khi cho X tác dụng với HCl thu được chất hữu cơ gồm 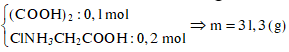
Câu 37:
Cho 86,3 gam hỗn hợp X gồm Na, K, Ba và Al2O3 (trong đó oxi chiếm 19,47% về khối lượng) tan hết vào nước, thu được dung dịch Y và 13,44 lít khí H2 (đktc). Cho 3,2 lít dung dịch HCl 0,75M vào dung dịch Y. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn D.
Theo đề ta có : ![]()
Khi hòa tan hỗn hợp X bằng nước. Xét dung dịch Y ta có:
![]()
![]()
Khi cho dung dịch Y tác dụng với 2,4 mol HCl, vì: ![]()
![]()
![]()
Câu 38:
Hòa tan hết 14,8 gam hỗn hợp Fe và Cu vào 126 gam dung dịch HNO3 48% thu được dung dịch X (không chứa muối amoni). Cho X phản ứng với 400 ml dung dịch NaOH 1M và KOH 0,5M thu được kết tủa Y và dung dịch Z. Nung Y trong không khí đến khối lượng không đổi thu được 20 gam Fe2O3 và CuO. Cô cạn dung dịch Z, thu được chất rắn khan T. Nung T trong không khí đến khối lượng không đổi, thu được 42,86 gam hỗn hợp chất rắn. Nồng độ phần trăm của Fe(NO3)3 trong X có giá trị gần nhất với giá trị nào sau đây ?
 Xem đáp án
Xem đáp án
Chọn B.
Gọi a và b lần lượt là số mol của Fe và Cu. Xét hỗn hợp chứa 20 gam Fe2O3 và CuO ta có :
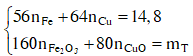
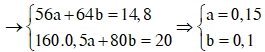
Dung dịch T gồm K+, Na+, OH- và NO3-. Khi nung chất rắn khan T thì :
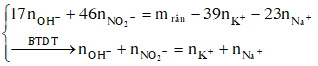
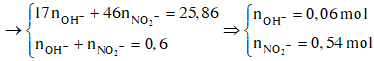
Dung dịch X gồm Fe2+, Fe3+, Cu2+(0,2 mol) và NO3- (với ). Xét X có:
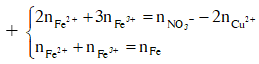
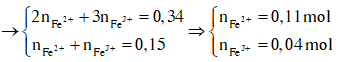
![]()
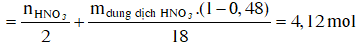
![]()
![]()
Câu 39:
Điện phân dung dịch chứa 0,2 mol NaCl và x mol Cu(NO3)2 với điện cực trơ, sau một thời gian thu được dung dịch X và khối lượng dung dịch giảm 21,5 gam. Cho thanh sắt vào dung dịch X đến khi các phản ứng xảy ra hoàn toàn thấy khối lượng thanh sắt giảm 1,8 gam và thấy thoát ra khí NO duy nhất. Giá trị của x là
 Xem đáp án
Xem đáp án
Chọn C.
Khí thoát ra tại anot gồm Cl2 (0,1 mol) và O2 (a mol).
![]() => mdd giảm = 64.(0,1 + 2a) + 71.0,1 + 32a = 21,5 Þ a = 0,05.
=> mdd giảm = 64.(0,1 + 2a) + 71.0,1 + 32a = 21,5 Þ a = 0,05.
Dung dịch X gồm NaNO3, HNO3 (4a = 0,2 mol) và Cu(NO3)2 dư (x – 0,2 mol).
Khi cho Fe vào dung dịch X thì:
3Fe + 8HNO3 ® 3Fe(NO3)2 + 2NO + 4H2O , Dmgiảm (1) = mFe ![]()
Fe + Cu(NO3)2 ® Fe(NO3)2 + Cu (2) , Dmtăng (2) = (64 – 56).(x – 0,2) = 8x – 1,6 (g)
Theo đề: 4,2 – (8x – 1,6) = 1,8 Þ x = 0,5.
