25 đề thi minh họa THPT Quốc gia môn Hóa học năm 2022 có đáp án
25 đề thi minh họa THPT Quốc gia môn Hóa học năm 2022 có đáp án (Đề 12)
-
4269 lượt thi
-
40 câu hỏi
-
90 phút
Danh sách câu hỏi
Câu 1:
Kim loại có nhiệt độ nóng chảy thấp nhất là
 Xem đáp án
Xem đáp án
Đáp án A
- Kim loại có nhiệt độ nóng chảy thấp nhất Hg.
- Kim loại có nhiệt độ nóng chảy cao nhất là .
Câu 3:
Mì chính là muối natri của axit glutamic, một amino axit tự nhiên quen thuộc và quan trọng. Mì chính không phải là vi chất dinh dưỡng, chỉ là chất tăng gia vị. Nếu ăn nhiều bột ngọt hay mì chính thì sẽ có cảm giác ngứa ran như kiến bò trên mặt, đầu hoặc cổ có cảm giác căng cứng ở mặt, nặng thì nhức đầu, chóng mặt, buồn nôn. Mì chính có tên hóa học là mononatri glutamat. Công thức hóa học của muối đó là
 Xem đáp án
Xem đáp án
Câu 8:
 Xem đáp án
Xem đáp án
Đáp án B
Câu 9:
 Xem đáp án
Xem đáp án
Đáp án A
Poli (etylen terephtalat) hay còn gọi là tơ lapsan được điều chế bằng phản ứng đồng trùng ngưng:
Câu 10:
 Xem đáp án
Xem đáp án
Đáp án A
Các kim loại có tính khử mạnh như Na, K, Mg, Al,... chỉ được điều chế bằng phương pháp điện phân nóng chảy.
Câu 11:
 Xem đáp án
Xem đáp án
Câu 13:
Cho m gam Fe phản ứng hoàn toàn với dung dịch HNO3 (dư), thu được 3,36 lít khí NO3 (đktc, sản phẩm khử duy nhất). Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Ta có:
Bte:
nên
Vậy
Câu 14:
Sục 7,84 lít CO2 (đktc) vào 250 ml dung dịch Ca(OH)2 1M. Khối lượng kết tủa thu được là
 Xem đáp án
Xem đáp án
Đáp án B
Ta có:
Nên sau phản ứng tạo 2 muối
Ta có:
Câu 15:
Có 3 chất lỏng benzen, anilin, stiren, đựng riêng biệt trong 3 lọ mất nhãn. Thuốc thử để phân biệt 3 chất lỏng trên là
 Xem đáp án
Xem đáp án
Đáp án B
|
Anilin |
Stiren |
Benzen |
|
Xuất hiện kết tủa trắng |
Mất màu dung dịch |
Không hiện tượng |
Câu 16:
 Xem đáp án
Xem đáp án
Đáp án D
Câu 17:
0,1 mol X tác dụng vừa đủ với dung dịch chứa 0,1 mol NaOH tạo 16,8 gam muối. Mặt khác, 0,1 mol X tác dụng vừa đủ với dung dịch chứa 0,2 mol HCl. Công thức cấu tạo phù hợp của X là
 Xem đáp án
Xem đáp án
Đáp án B
Amino axit X:
X có dạng
Suy ra X là .
Câu 18:
 Xem đáp án
Xem đáp án
Đáp án A
Đồng phân là những chất có cùng công thức phân tử nhưng khác nhau về cấu tạo.
Câu 20:
Thủy phân hoàn toàn tinh bột trong dung dịch axit vô cơ loãng, thu được chất hữu cơ X. Cho X phản ứng với khí (xúc tác Ni, đun nóng) thu được chất hữu cơ Y. Các chất X, Y lần lượt là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 21:
Để tách được Ag từ hỗn hợp gồm Ag, Fe, Cu mà không làm tăng khối lượng Ag người ta dùng
 Xem đáp án
Xem đáp án
Đáp án A
Giải thích: Chất được chọn phải tác dụng với Fe, Cu mà không tác dụng với Ag: . Đồng thời không làm tăng khối lượng Ag:
Câu 23:
Bằng một phương trình hóa học, từ chất hữu cơ X có thể điều chế chất hữu cơ Y có phân tử khối bằng 60. Chất X không thể là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 24:
 Xem đáp án
Xem đáp án
Đáp án A
Nguyên tố Fe trong FeO có số oxi hóa +2 là số oxi hóa trung gian giữa 0 và +3. Nên FeO vừa thể hiện tính khử, vừa thể hiện tính oxi hóa.
Câu 25:
 Xem đáp án
Xem đáp án
Đáp án C
Câu 26:
Cho m gam hỗn hợp E gồm este X () và este Y () với dung dịch NaOH vừa đủ, thu được hỗn hợp Z gồm hai ancol kế tiếp và 13,22 gam muối. Dẫn toàn bộ Z qua bình đựng Na dư, thấy khối lượng bình tăng 6,22 gam. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B
X chỉ có thể là este: mol
Hỗn hợp Z gồm hai ancol kế tiếp nên Z gồm mol và mol.
Este Y: mol
Khối lượng bình tăng 6,22 gam do khối lượng ancol cho vào nhiều hơn khối lượng khí hiđro thoát ra là 6,22 gam.
gam
Câu 27:
 Xem đáp án
Xem đáp án
Đáp án D
Cả 3 cách đều làm cho cân bằng phản ứng chuyển theo chiều thuận tạo ra este.
|
Ghi chú: Cách làm tăng hiệu suất phản ứng este hóa: - Cho dư rượu etylic hoặc dư axit axetic - Dùng đặc để hút nước - Chưng cất ngay để lấy este ra |
Câu 28:
Cho các chất Al, . Số chất vừa phản ứng với dung dịch NaOH vừa phản ứng với dung dịch HCl là
 Xem đáp án
Xem đáp án
Đáp án A
Những chất vừa phản ứng với dung dịch NaOH vừa phản ứng với dung dịch HCl là
Câu 29:
 Xem đáp án
Xem đáp án
Đáp án D
Xem hỗn hợp X phản ứng với CO:
Xem phản ứng giữa oxit vào HCl:
Câu 30:
Đốt cháy hoàn toàn X mol hiđrocacbon X (40 < MX < 70) mạch hở, thu được CO2 và 0,2 mol H2O. Mặt khác, cho x mol X tác dụng với AgNO3 dư trong dung dịch , thì có 0,2 mol phản ứng. Sau phản ứng thu được m gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B
BTNT H:
Với (loại)
Với X có công thức: (64) (thỏa mãn)
Câu 31:
Nung nóng m gam hỗn hợp Al và (trong môi trường không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn Y. Chia Y thành hai phần bằng nhau:
- Phần 1 tác dụng với dung dịch loãng (dư), sinh ra 3,08 lít khí H2 (ở đktc)
- Phần 2 tác dụng với dung dịch NaOH (dư), sinh ra 0,84 lít khí H2 (ở đktc).
Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Phần 2:
mol
Phần 1:
Câu 32:
Tiến hành thí nghiệm với các chất X, Y, Z, T. Kết quả được ghi ở bảng sau:
|
Mẫu thử |
Thí nghiệm |
Hiện tượng |
|
X |
trong môi trường kiềm |
Tác dụng với nước brom |
|
Y |
Đun nóng với dung dịch NaOH (loãng, dư) để nguội. Thêm vài giọt dung dịch . |
Tạo dung dịch xanh lam. |
|
Z |
Quỳ tím |
Quỳ tím chuyển xanh |
|
T |
Tác dụng với nước brom |
Có kết tủa trắng |
Các chất X, Y, Z, T lần lượt là
 Xem đáp án
Xem đáp án
Đáp án B
X: Saccarozơ tạo phức xanh lam với trong môi trường kiềm.
Y: Triolein thủy phân trong môi trường kiềm thu được glixerol tác dụng được với .
Z: Metylamin hay lysin đều có tính bazơ làm quỳ tím hóa xanh.
T: Phenol và anilin đều tác dụng với nước brom tạo kết tủa trắng.
Câu 33:
Điện phân dung dịch X chứa và KCl với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi . Số mol khí sinh ra ở cả hai điện cực (mol) theo thời gian điện phân t (giây) được biểu diễn như hình vẽ, hiệu suất điện phân 100%, các khí sinh ra không tan trong nước.
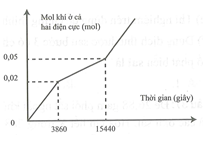
Nếu điện phân dung dịch X trong thời gian 11580 giây rồi cho dung dịch sau điện phân tác dụng với lượng dư Mg thấy có 0,01 mol NO thoát ra. Dung dịch sau phản ứng chứa m gam chất tan. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Giai đoạn 1: Khí Cl2 thoát ra. Cl- điện phân hết.
Giai đoạn 2: Khí O2 thoát ra.
Lúc này chỉ có khí O2 và Cl2, khí H2 sẽ bắt đầu xuất hiện ở giai đoạn sau, nên Cu2+ điện phân hết.
BT e:
Vậy dung dịch sau điện phân chứa:
Câu 34:
Cho m gam hỗn hợp X gồm đimetyl oxalat, phenyl axetat và etyl acrylat tác dụng tối đa với 250 ml dung dịch NaOH 1M, thu được hỗn hợp Y gồm hai ancol và 21,74 gam hỗn hợp muối Z. Đốt cháy hoàn toàn Y, thu được 11,44 gam và 7,74 gam . Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Vì
Chỉ có thủy phân không tạo ancol, nên sự chênh lệch số mol NaOH và ancol chính là số mol của
BTKL:
|
Ghi chú: Điểm quan trọng để giải bài toán này là xác định được: sự chênh lệch số mol NaOH và ancol chính là số mol của do thủy phân trong NaOH không tạo ancol. |
Câu 35:
Nung nóng 48,12 gam hỗn hợp gồm và trong khí trơ, sau một thời gian, thu được rắn X. Chia X làm hai phần bằng nhau, phần một cho vào dung dịch NaOH loãng dư, thấy lượng NaOH phản ứng là 13,6 gam; đồng thời thu được 7,68 gam rắn. Hòa tan hết phần hai trong dung dịch HCl loãng, đun nóng (dùng dư), thu được 2,464 lít khí H2 (đktc) và dung dịch chứa 61,57 gam muối. Biết rằng trong phản ứng nhiệt nhôm, chỉ bị khử thành Cr. Hiệu suất phản ứng nhiệt nhôm là
 Xem đáp án
Xem đáp án
Đáp án A
Hỗn hợp ban đầu gồm:
Phản ứng nhiệt nhôm:
Hiệu suất phản ứng tính theo Al vì
Câu 36:
Tiến hành các bước thí nghiệm như sau:
Bước 1: Cho một nhúm bông vào cốc đựng dung dịch 70%, đun nóng đồng thời khuấy đều đến khi thu được dung dịch đồng nhất.
Bước 2: Trung hòa dung dịch thu được bằng dung dịch NaOH 10%.
Bước 3: Lấy dung dịch sau khi trung hòa cho vào ống nghiệm đựng dung dịch dư, đun nóng trên ngọn lửa đèn cồn.
Cho các phát biểu sau:
(a) Sau bước 1, trong cốc thu được một loại monosaccarit.
(b) Sau bước 3, trên thành ống nghiệm xuất hiện lớp kim loại màu trắng bạc.
(c) Trong bước 2, có thể thay dung dịch NaOH 10% bằng dung dịch KOH 14%.
(d) Trong bước 3, có thể thay việc đun trên ngọn lửa đèn cồn bằng cách ngâm trong cốc nước nóng.
(e) Thí nghiệm trên dùng để chứng minh xenlulozơ có chứa nhiều nhóm -OH.
(f) Dung dịch thu được sau bước 3 có chứa axit gluconic.
Số phát biểu sai là
 Xem đáp án
Xem đáp án
Đáp án B
Những phát biểu đúng: (a), (b), (c), (d).
(a) đúng. Monosaccarit là glucozơ.
(b) đúng. Glucozơ tác dụng với sinh ra Ag.
(c) đúng
(e) sai. Thí nghiệm trên chứng minh xenlulozơ thủy phân trong môi trường axit thu được glucozơ.
(f) sai. Dung dịch thu được chứa muối amoni gluconat.
Câu 37:
Để 26,88 gam phôi sắt ngoài không khí 1 thời gian thu được hỗn hợp rắn X gồm Fe và các oxit sắt. Hòa tan hết X trong 288 gam dung dịch 31,5% thu được dung dịch Y chứa các muối và hỗn hợp khí Z gồm 2 khí, trong đó oxi chiếm 61,11% về khối lượng. Cô cạn dung dịch Y, sau đó nung đến khối lượng không đổi thấy khối lượng chất rắn giảm 67,84 gam. Nồng độ có trong dung dịch Y là
 Xem đáp án
Xem đáp án
Đáp án C
BT N:
BT H:
BT O:
BTKL:
Câu 38:
Chất X () là muối amoni của axit cacboxylic đa chức, chất Y () là pentapeptit được tạo bởi một amino axit. Cho 0,26 mol hỗn hợp Z gồm X và Y tác dụng tối đa với dung dịch chứa 0,7 mol NaOH đun nóng, thu được etylamin và dung dịch chứa 62,9 gam hỗn hợp muối. Phần trăm khối lượng của X trong Z có giá trị gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Chọn D
BTKL:
Câu 39:
Tiến hành các thí nghiệm sau:
(1) Cho dung dịch NaOH vào dung dịch .
(2) Cho dung dịch HCl tới dư vào dung dịch .
(3) Sục khí vào dung dịch .
(4) Sục khí tới dư vào dung dịch .
(5) Sục khí tới dư vào dung dịch .
(6) Sục khí etilen vào dung dịch .
Sau khi các phản ứng kết thúc, có bao nhiêu thí nghiệm thu được kết tủa?
 Xem đáp án
Xem đáp án
Đáp án B
Câu 40:
 Xem đáp án
Xem đáp án
Đáp án A
