Giải Sách bài tập Hoá học 10 Cánh diều Bài 18: Hydrogen halide và hydrohalic acid
Với giải sách bài tập Hoá học 10 Bài 18: Hydrogen halide và hydrohalic acidCánh diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hoá học 10 Bài 18
Giải sách bài tập Hóa học lớp 10 Bài 18: Hydrogen halide và hydrohalic acid
Bài 18.1 trang 62 SBT Hóa học 10: Những phát biểu nào dưới đây là đúng khi nói về các hydrogen halide HX?
A. Ở điều kiện thường, đều là chất khí.
B. Các phân tử đều phân cực.
C. Nhiệt độ sôi tăng từ hydrogen chloride đến hydrogen iodide, phù hợp với xu hướng tăng tương tác van der Waals từ hydrogen chloride đến hydrogen iodide.
D. Đều tan tốt trong nước, tạo các dung dịch hydrohalic acid tương ứng.
E. Năng lượng liên kết tăng dần từ HF đến HI.
Lời giải:
Đáp án đúng là: A, B, C, D
Phát biểu E sai vì: Năng lượng liên kết giảm dần từ HF đến HI.
Bài 18.2 trang 62 SBT Hóa học 10: Ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao vượt trội so với các hydrogen halide còn lại là do
A. fluorine có nguyên tử khối nhỏ nhất.
B. năng lượng liên kết H – F bền vững làm cho HF khó bay hơi.
C. các nhóm phân tử HF được tạo thành do có liên kết hydrogen giữa các phân tử.
D. fluorine là phi kim mạnh nhất.
Lời giải:
Đáp án đúng là: C
Ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao vượt trội so với các hydrogen halide còn lại là do các nhóm phân tử HF được tạo thành do có liên kết hydrogen giữa các phân tử.
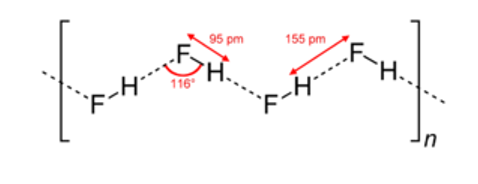
Bài 18.3 trang 63 SBT Hóa học 10: Những phát biểu nào dưới đây là không đúng khi nói về các hydrohalic acid?
A. Đều là các acid mạnh.
B. Độ mạnh của acid tăng từ hydrofluoric acid đến hydroiodic acid, phù hợp xu hướng giảm độ bền liên kết từ HF đến HI.
C. Hoà tan được các oxide của kim loại, phản ứng được với các hydroxide kim loại.
D. Hoà tan được tất cả các kim loại.
E. Tạo môi trường có pH lớn hơn 7.
Lời giải:
Đáp án đúng là: A, D và E
Phát biểu A sai vì: HF là acid yếu.
Phát biểu D sai vì: các hydrohalic acid không hoàn tan được các kim loại như Cu, Ag, Au, Pt …
Phát biểu E sai vì: các hydrohalic acid tạo môi trường có pH < 7.
Bài 18.4 trang 63 SBT Hóa học 10: Những phát biểu nào sau đây là đúng khi nói về ion halide X-?
A. Dùng dung dịch silver nitrate sẽ phân biệt được các ion F-, Cl-, Br-, I-.
B. Với sulfuric acid đặc, các ion Cl-, Br-, I- thể hiện tính khử, ion F- không thể hiện tính khử.
C. Tính khử của các ion halide tăng theo dãy: Cl-, Br-, I-.
D. Ion Cl- kết hợp ion Ag+ tạo AgCl là chất không tan, màu vàng.
Lời giải:
Đáp án đúng là: A và C
Phát biểu B sai vì với sulfuric acid đặc, ion Cl- không thể hiện tính khử.
Phát biểu D sai vì ion Cl- kết hợp ion Ag+ tạo AgCl là chất không tan, màu trắng.
Bài 18.5 trang 63 SBT Hóa học 10: Những phát biểu nào sau đây là không đúng khi nói về ứng dụng hiện nay của một số hydrogen halide và hydrohalic acid?
A. Hằng năm, cần hàng chục triệu tấn hydrogen chloride để sản xuất hydrochloric acid.
B. Lượng lớn hydrochloric acid sử dụng trong sản xuất nhựa, phân bón, thuốc nhuộm,...
C. Hydrochloric acid được sử dụng cho quá trình thuỷ phân các chất trong sản xuất, chế biến thực phẩm.
D. Hydrofluoric acid hoặc hydrogen fluoride phản ứng với chlorine dùng để sản xuất fluorine.
E. Trong công nghiệp, hydrofluoric acid dùng tẩy rửa các oxide của sắt trên bề mặt của thép.
G. Hydrogen fluoride được dùng để sản xuất chất làm lạnh hydrochlorofluorocarbon HCFC (thay thế chất CFC), chất chảy cryolite, …
Lời giải:
Đáp án đúng là: D và E
Phát biểu D sai vì: Fluorine được điều chế bằng cách điện phân hỗn hợp KF, HF.
Phát biểu E sai vì: Trong công nghiệp, hydrochloric acid dùng tẩy rửa các oxide của sắt trên bề mặt của thép.
Bài 18.6 trang 64 SBT Hóa học 10: Những tính chất nào dưới đây thể hiện tính acid của hydrochloric acid?
A. Phản ứng với các hydroxide.
B. Hoà tan các oxide của kim loại.
C. Hoà tan một số kim loại.
D. Phản ứng với phi kim.
E. Làm quỳ tím hóa đỏ và tạo môi trường pH > 7.
G. Phân li ra ion H+.
H. Khi phản ứng với kim loại thì tạo ra muối và khí hydrogen.
Lời giải:
Đáp án đúng là: A, B, C, G và H
Phát biểu D sai vì hydrochloric acid không phản ứng với phi kim.
Phát biểu E sai vì hydrochloric acid tạo môi trường pH < 7.
Bài 18.7 trang 64 SBT Hóa học 10: Nối mỗi chất trong cột A với tính chất tương ứng của chúng trong cột B cho phù hợp.
|
Cột A |
Cột B |
|
a) Hydrogen fluoride b) Hydrofluoric acid c) Hydrogen chloride d) Hydrochloric acid |
1. Là chất khí ở điều kiện thường. 2. Các phân tử tạo liên kết hydrogen với nhau. 3. Có nhiệt độ sôi cao nhất trong dãy hydrogen halide. 4. Là acid mạnh. 5. Ăn mòn thuỷ tinh. 6. Thường được dùng để thuỷ phân các chất trong quá trình sản xuất. 7. Hoà tan calcium carbonate có trong đá vôi, magnesium hydroxide, copper(II) oxide. |
Lời giải:
- a ghép với 1, 2, 3:
a) Hydrogen fluoride:
1. Là chất khí ở điều kiện thường.
2. Các phân tử tạo liên kết hydrogen với nhau.
3. Có nhiệt độ sôi cao nhất trong dãy hydrogen halide.
- b ghép với 5, 7:
b) Hydrofluoric acid:
5. Ăn mòn thuỷ tinh.
7. Hoà tan calcium carbonate có trong đá vôi, magnesium hydroxide, copper(II) oxide.
- c ghép với 1:
c) Hydrogen chloride:
1. Là chất khí ở điều kiện thường.
- d ghép với 4, 6, 7:
d) Hydrochloric acid
4. Là acid mạnh.
6. Thường được dùng để thuỷ phân các chất trong quá trình sản xuất.
7. Hoà tan calcium carbonate có trong đá vôi, magnesium hydroxide, copper(II) oxide.
Bài 18.8 trang 64 SBT Hóa học 10: Những phát biểu nào sau đây là đúng?
A. Khi cho potassium bromide rắn phản ứng với sulfuric acid đặc thu được khí hydrogen bromide.
B. Hydrofluoric acid không nguy hiểm vì nó là một acid yếu.
C. Trong phản ứng điều chế nước Javel bằng chlorine và sodium hydroxide, chlorine vừa đóng vai trò chất oxi hoá, vừa đóng vai trò chất khử.
D. Fluorine có số oxi hoá bằng -1 trong các hợp chất.
E. Tất cả các muối halide của bạc (AgF, AgCl, AgBr, AgI) đều là những chất không tan trong nước ở nhiệt độ thường.
G. Ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao nhất trong các hydrogen halide là do liên kết H – F bền nhất trong các liên kết H – X.
Lời giải:
Đáp án đúng là: C và D
Phát biểu A sai vì:
2KBr(s) + 3H2SO4(l) → 2KHSO4(s) + Br2(g) + SO2(g) + 2H2O(g)
Như vậy tạo ra khí SO2 và hơi Br2.
Phát biểu B sai vì HF có độc tính rất mạnh.
Phát biểu E sai vì AgF tan trong nước.
Phát biểu G sai vì ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao nhất trong các hydrogen halide là do giữa các phân tử hydrogen fluoride còn tạo liên kết hydrogen với nhau.
Bài 18.9 trang 64 SBT Hóa học 10: Các phân tử HX đều phân cực, nhưng chỉ có các phân tử HF tạo được liên kết hydrogen với nhau. Giải thích.
Lời giải:
Các phân tử HX đều phân cực, nhưng chỉ có các phân tử HF tạo được liên kết hydrogen với nhau vì nguyên tử F trong HF vẫn còn cặp electron riêng và đặc biệt F có độ âm điện lớn.
Bài 18.10 trang 65 SBT Hóa học 10: Hãy đề xuất cách phân biệt bốn dung dịch hydrohalic acid bằng phương pháp hóa học.
Lời giải:
Đề xuất cách phân biệt:
- Đánh số thứ tự từng lọ dung dịch, trích mẫu thử.
- Cho từ từ một vài giọt dung dịch silver nitrade (AgNO3) vào từng mẫu thử.
+ Nếu không có hiện tượng xảy ra là hydrofluoric acid.
+ Nếu có kết tủa trắng xuất hiện là hydrochloric acid.
AgNO3(aq) + HCl(aq) → AgCl(s) + HNO3
+ Nếu có kết tủa vàng nhạt xuất hiện là hydrobromic acid.
AgNO3(aq) + HBr(aq) → AgBr(s) + HNO3
+ Nếu có kết tủa vàng xuất hiện là hydroiodic acid.
AgNO3(aq) + HI(aq) → AgI(s) + HNO3
Bài 18.11 trang 65 SBT Hóa học 10: Hoàn thành phương trình hóa học của mỗi phản ứng sau:
a) HCl(aq) + KMnO4(s) → KCl(aq) + MnCl2(aq) + Cl2(g) + H2O(l)
b) MnO2(s) + HCl(aq) → MnCl2(aq) + ? + H2O(l)
c) Cl2(g) + ? → ? + NaClO3(aq) + H2O(l)
d) NaBr(s) + H2SO4(l) → NaHSO4(s) + ? + SO2(g) + H2O(g)
e) HI(g) + ? → I2(g) + H2S(g) + H2O(l).
Lời giải:
a) 16HCl(aq) + 2KMnO4(s) → 2KCl(aq) + 2MnCl2(aq) + 5Cl2(g) + 8H2O(l)
b) MnO2(s) + 4HCl(aq) → MnCl2(aq) + Cl2(g) + 2H2O(l)
c) 3Cl2(g) + 6NaOH(aq) → 5NaCl(aq) + NaClO3(aq) + 3H2O(l)
d) 2NaBr(s) + 3H2SO4(l) → 2NaHSO4(s) + Br2(g) + SO2(g) + 2H2O(g)
e) 8HI(g) + H2SO4(l) → 4I2(g) + H2S(g) + 4H2O(l).
Bài 18.12 trang 65 SBT Hóa học 10: Điền vào chỗ trống tên gọi hoặc công thức phân tử của các chất tương ứng:
a) …….: HI
b) …….: NaCl
c) Potassium iodide: …….
d) …….: NaClO
Lời giải:
a) Hydrogen iodide: HI
b) Sodium chloride: NaCl
c) Potassium iodide: KI
d) Sodium hypochlorite: NaClO
Bài 18.13 trang 65 SBT Hóa học 10:
a) X là các nguyên tố bền thuộc nhóm halogen. Hãy điền công thức hóa học của nguyên tố, chất, ion theo thứ tự với các tính chất tương ứng theo bảng sau:
b) Viết các phản ứng chứng minh sự thay đổi tính khử của các ion X- theo xu hướng trong bảng tuần hoàn đã được hoàn thành ở câu a.
c) Tìm hiểu và giải thích vì sao tính acid của các hợp chất HX lại được thay đổi theo thứ tự như câu a.
Lời giải:
a)
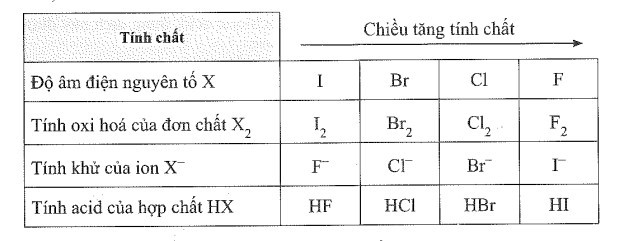
b) Phản ứng chứng minh tính khử của các ion tăng dần theo thứ tự: F-, Br-, Cl-, I-:
Phản ứng với sulfuric acid đặc trong cùng điều kiện:
NaF(s) + H2SO4(l) → NaHSO4(s) + HF(g)
NaCl(s) + H2SO4(l) → NaHSO4(s) + HCl(g)
2NaBr(s) + 3H2SO4(l) → 2NaHSO4(s) + Br2(g) + SO2(g) + 2H2O(g)
8NaI(s) + 9H2SO4(l) → 8NaHSO4(s) + H2S(g) + 4I2(g) + 4H2O(g)
Dễ thấy F- và Cl- không thể hiện tính khử; Br- khử lưu huỳnh (sulfur) có số oxi hóa +6 về số oxi hóa +4; I- có thể khử lưu huỳnh (sulfur) có số oxi hóa +6 xuống số oxi hóa thấp hơn là -2.
Vậy tính khử I- > Br-> Cl-, F- (1).
Mặt khác, Cl- trong HCl đặc có thể khử MnO2 theo phản ứng sau:
MnO2(s) + 4HCl(aq) → MnCl2(aq) + Cl2(g) + 2H2O(l)
Phản ứng này dùng để điều chế Cl2 trong phòng thí nghiệm, trong khi đó F- trong điều kiện tương tự thì không xảy ra phản ứng. Ngoài ra, F- gần như không thể bị oxi hóa bởi các hóa chất khác trong điều kiện thông thường.
Vậy tính khử Cl- > F- (2)
Từ (1) và (2) suy ra điều cần chứng minh.
c) Nguyên nhân chủ yếu làm tăng độ mạnh của các acid theo dãy HF, HCl, HBr, HI là do sự giảm độ bền liên kết theo thứ tự: H – F > H – Cl > H – Br > H – I.
Bài 18.14 trang 65 SBT Hóa học 10: Mỗi năm, hàng triệu tấn hydrochloric acid được cho phản ứng với acetylene (hay ethyne) và ammonia.
a) Viết phương trình hóa học của hai phản ứng trên.
b) Hai phản ứng trên được dùng trong lĩnh vực sản xuất nào?
Lời giải:
a) Các phương trình hóa học:
HCl + HC ≡ CH → H2C = CHCl (1)
HCl + NH3 → NH4Cl (2)
b) Phản ứng (1) được ứng dụng trong sản xuất nhựa PVC;
Phản ứng (2) được ứng dụng trong sản xuất phân đạm.
Bài 18.15 trang 65 SBT Hóa học 10: Một trong những ứng dụng quan trọng của hydrochloric acid là dùng để loại bỏ gỉ thép trước khi đem cán, mạ điện, … Theo đó, thép sẽ được ngâm trong hydrochloric acid nồng độ khoảng 18% theo khối lượng. Các oxide tạo lớp gỉ trên bề mặt của thép, chủ yếu là các oxide của sắt và một phần sắt sẽ bị hòa tan bởi acid. Quá trình này thu được dung dịch (gọi là dung dịch A), chủ yếu chứa hydrochloric acid dư và iron(II) chloride được tạo ra từ phản ứng sắt khử ion Fe3+.
a) Viết phương trình hóa học của các phản ứng diễn ra. Các phản ứng này có phát thải khí độc vào môi trường không?
b) Để tái sử dụng acid, dung dịch A được đưa đến thiết bị phun, ở khoảng 180 oC để thực hiện phản ứng:
4FeCl2 + 4H2O + O2 → 8HCl + 2Fe2O3
Sau quá trình trên, cần làm thế nào để thu được hydrochloric acid?
Lời giải:
a) Các phương trình hóa học của các phản ứng diễn ra:
FeO(s) + 2HCl(aq) → FeCl2(aq) + H2O(l)
Fe2O3(s) + 6HCl(aq) → 2FeCl3(aq) + 3H2O(l)
Fe(s) + 2HCl(aq) → FeCl2(aq) + H2(g)
Fe(s) + 2FeCl3(aq) → 3FeCl2(aq)
b) Phản ứng 4FeCl2 + 4H2O + O2 → 8HCl + 2Fe2O3 diễn ra ở nhiệt độ cao, thu khí hydrogen chloride. Khí này cần được hòa tan vào nước để thu lại hydrochloric acid, dung dịch này được tái sử dụng.
Bài 18.16 trang 66 SBT Hóa học 10: Xét phản ứng sau:
4HI(aq) + O2(g) → 2H2O(l) + 2I2(s)
Cho giá trị enthalpy tạo thành chuẩn (kJ mol-1) của một số chất trong bảng dưới đây:
|
HI (aq) |
H2O (l) |
O2 (g) |
I2 (s) |
|
-55 |
-285 |
? |
? |
a) Điền giá trị phù hợp vào ô còn trống.
b) Xác định biến thiên enthalpy chuẩn của phản ứng trên.
c) Nếu chỉ dựa vào giá trị biến thiên enthalpy chuẩn thì phản ứng trên có thuận lợi về mặt năng lượng không? Từ đó, hãy dự đoán hiện tượng xảy ra khi dung dịch hydroiodic acid tiếp xúc với không khí.
d) Thực tế, người ta phải chứa hydroiodic acid trong chai, lọ được đậy kín. Hãy giải thích.
Lời giải:
a)
|
HI (aq) |
H2O (l) |
O2 (g) |
I2 (s) |
|
-55 |
-285 |
0 |
0 |
b)
= 2 × (-285) + 2 × 0 – 4 × (-55) – 0 = -350 (kJ)
c) Phản ứng oxi hóa acid bởi oxygen thuận lợi về mặt năng lượng.
Khi dung dịch hydroiodic acid tiếp xúc với không khí, dung dịch bị biến đổi (thành phần, màu sắc) theo phản ứng:
4HI(aq) + O2(g) → 2H2O(l) + 2I2(s)
d) Thực tế, người ta phải chứa hydroiodic acid trong chai, lọ được đậy kín để giảm sự tiếp xúc của dung dịch với oxygen có trong không khí.
Bài 18.17 trang 66 SBT Hóa học 10: Trong phòng thí nghiệm, hydrochloric acid đặc có thể được dùng để điều chế khí chlorine theo hai phản ứng sau:
16HCl(aq) + 2KMnO4(s) → 2MnCl2(aq) + 2KCl(aq) + 8H2O(l) + 5Cl2(g) (1)
4HCl(aq) + MnO2(s) → MnCl2(aq) + 2H2O(l) + Cl2(g) (2)
Cho bảng giá trị enthalpy tạo thành chuẩn (kJ mol-1) của các chất như dưới đây:
|
HCl(aq) |
KMnO4(s) |
MnO2(s) |
MnCl2(aq) |
KCl(aq) |
H2O(l) |
|
-167 |
-837 |
-520 |
-555 |
-419 |
-285 |
a) Hãy tính biến thiên enthalpy chuẩn của mỗi phản ứng.
b) Thực tế, không cần đun nóng, hai phản ứng trên vẫn diễn ra ở nhiệt độ phòng. Vậy phản ứng trên đã có thể thu nhiệt từ đâu?
Lời giải:
a) 16HCl(aq) + 2KMnO4(s) → 2MnCl2(aq) + 2KCl(aq) + 8H2O(l) + 5Cl2(g) (1)
= 2 × (-555) + 2 × (-419) + 8 × (-285) + 5 × 0 – 16 × (-167) – 2 × (-837) = 118 (kJ)
4HCl(aq) + MnO2(s) → MnCl2(aq) + 2H2O(l) + Cl2(g) (2)
= (-555) + 2 × (-285) + 0 – 4 × (-167) – ( -520) = 63(kJ).
b) Thực tế, không cần đun nóng, hai phản ứng trên vẫn diễn ra ở nhiệt độ phòng do các phản ứng này thu nhiệt từ môi trường.
Bài viết liên quan
- Giải Sách bài tập Hoá học 10 Cánh diều Bài 13: Phản ứng oxi hóa – khử
- Giải Sách bài tập Hoá học 10 Cánh diều Bài 14: Phản ứng hóa học và enthalpy
- Giải Sách bài tập Hoá học 10 Cánh diều Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
- Giải Sách bài tập Hoá học 10 Cánh diều Bài 16: Tốc độ phản ứng hóa học
- Giải Sách bài tập Hoá học 10 Cánh diều Bài 17: Nguyên tố và đơn chất halogen
