Thi Online (2023) Đề thi thử Hóa THPT Việt Nam- Ba Lan, Hà Nội (Lần 2) có đáp án
Thi Online (2023) Đề thi thử Hóa THPT Việt Nam- Ba Lan, Hà Nội (Lần 2) có đáp án
-
356 lượt thi
-
40 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Vào mùa lũ, để có nước sử dụng, dân cư ở một số vùng thường sử dụng chất X (Có công thức K2SO4.Al2(SO4)3.24H2O) để làm trong nước. Chất X được gọi là
 Xem đáp án
Xem đáp án
Chọn B
Câu 4:
Có thể chuyên chở HNO3 đặc, nguội bằng bình làm từ kim loại sau đây:
 Xem đáp án
Xem đáp án
Có thể chuyên chở HNO3 đặc, nguội bằng bình làm từ Al do Al bị thụ động (không tan) trong HNO3 đặc, nguội.
Chọn B
Câu 5:
Cho 15,9 gam Na2CO3 tác dụng hết với dung dịch HCl dư, thu được V lít khí CO2. Giá trị của V là
 Xem đáp án
Xem đáp án
Na2CO3 + 2HCl —> 2NaCl + CO2 + H2O
nCO2 = nNa2CO3 = 0,15 —> V = 3,36 lít
Chọn C
Câu 6:
Khi điện phân NaCl nóng chảy (điện cực trơ), tại catôt xảy ra
 Xem đáp án
Xem đáp án
Tại catot (cực âm) ion Na+ di chuyển tới, tại đây nó sẽ bị khử:
Na+ + 1e —> Na (Sự khử Na+)
Chọn B
Câu 7:
Cho các phát biểu sau:
(a) Sục khí CO2 tới dư vào dung dịch NaAlO2, thu được kết tủa trắng.
(b) Nhỏ dung dịch Ba(HCO3)2 vào dung dịch KHSO4, thu được kết tủa trắng và có khí thoát ra.
(c) Dung dịch Na2CO3 làm mềm được nước cứng toàn phần.
(d) Thạch cao nung dùng để nặn tượng, bó bột khi gãy xương.
(e) Hợp kim liti – nhôm siêu nhẹ, được dùng trong kĩ thuật hàng không.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Tất cả đều đúng:
(a) CO2 + NaAlO2 + 2H2O —> Al(OH)3 + NaHCO3
(b) Ba(HCO3)2 + KHSO4 —> BaSO4 + K2SO4 + CO2 + H2O
(c) CO32- + M2+ —> MCO3 (M là Ca, Mg)
(d), (e) Đúng
Chọn A
Câu 8:
Cho 5 gam một kim loại kiềm thổ tác dụng hết với nước thoát ra 2,8 lít khí (đktc). Tên của kim loại kiềm thổ đó là
 Xem đáp án
Xem đáp án
R + 2H2O —> R(OH)2 + H2
nR = nH2 = 0,125 —> MR = 5/0,125 = 40
—> R là Ca
Chọn C
Câu 9:
Trong công nghiệp, Mg được điều chế bằng cách nào dưới đây?
 Xem đáp án
Xem đáp án
Trong công nghiệp, Mg được điều chế bằng cách điện phân nóng chảy MgCl2:
MgCl2 điện phân nóng chảy —> Mg (catot) + Cl2 (anot)
Chọn C
Câu 10:
Fe bị ăn mòn điện hoá học khi tiếp xúc với kim loại M, để ngoài không khí ẩm. Vậy M là
 Xem đáp án
Xem đáp án
Fe bị ăn mòn điện hoá học khi tiếp xúc với kim loại M, để ngoài không khí ẩm —> Fe có tính khử mạnh hơn M
—> M là Cu.
Chọn C
Câu 12:
Khi cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 thấy có
 Xem đáp án
Xem đáp án
Khi cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 thấy có kết tủa trắng xuất hiện:
Ca(OH)2 + Ca(HCO3)2 —> 2CaCO3 + 2H2O
Chọn C
Câu 13:
Cho 24,3 gam Al tác dụng với 13,44 lít O2 đktc, thu được hỗn hợp A. Hòa tan A trong HNO3 dư, thu được V lít NO (sản phẩm khử duy nhất, đktc). Giá trị của V là:
 Xem đáp án
Xem đáp án
nAl = 0,9; nO2 = 0,6
Bảo toàn electron: 3nAl = 4nO2 + 3nNO
—> nNO = 0,1 —> V = 2,24 lít
Chọn C
Câu 15:
Cho phản ứng: aAl + bHNO3 → cAl(NO3)3 + dNO2 + eH2O. Tỉ lệ a/b là:
 Xem đáp án
Xem đáp án
Al + 6HNO3 —> Al(NO3)3 + 3NO2 + 3H2O
—> a/b = 1/6
Chọn D
Câu 17:
Cho Na vào dung dịch CuCl2 hiện tượng quan sát được là:
 Xem đáp án
Xem đáp án
Cho Na vào dung dịch CuCl2 hiện tượng quan sát được là: Sủi bọt khí và xuất hiện kết tủa xanh.
2Na + 2H2O —> 2NaOH + H2
2NaOH + CuCl2 —> Cu(OH)2 + 2NaCl
Chọn B
Câu 18:
Nước cứng không gây ra tác hại nào dưới đây?
 Xem đáp án
Xem đáp án
Nước cứng không gây ngộ độc nước uống.
Chọn D
Câu 19:
Nguyên tử của kim loại kiềm có n lớp electron. Cấu hình electron lớp ngoài cùng của nguyên tử kim loại kiềm là
 Xem đáp án
Xem đáp án
Chọn C
Câu 20:
Dung dịch nào sau đây không thể làm mềm nước cứng tạm thời?
 Xem đáp án
Xem đáp án
Dung dịch HCl không thể làm mềm nước cứng tạm thời do không loại bỏ được Ca2+, Mg2+ dưới dạng kết tủa.
Chọn B
Câu 21:
Dẫn chậm V lit CO2 (đktc) vào dung dịch Ca(OH)2 thu được 15 gam kết tủa và dung dịch X, đun nóng dung dịch lại thu thêm được 5 gam kết tủa nữa. Giá trị của V là
 Xem đáp án
Xem đáp án
nCaCO3 = 0,15
nCa(HCO3)2 = nCaCO3 thu thêm khi đun = 0,05
—> nCO2 = nCaCO3 + 2nCa(HCO3)2 = 0,25
—> V = 5,6 lít
Chọn D
Câu 22:
Khi nói về kim loại kiềm, phát biểu nào sau đây là sai?
 Xem đáp án
Xem đáp án
D sai, từ Li đến Cs tính kim loại tăng dần nên khả năng phản ứng với nước tăng dần.
Chọn D
Câu 23:
Chất nào sau đây tác dụng với dung dịch KHCO3 sinh ra khí CO2?
 Xem đáp án
Xem đáp án
HCl + KHCO3 —> KCl + CO2 + H2O
Chọn B
Câu 24:
Canxi cacbonat được dùng sản xuất vôi, thủy tinh, xi măng. Công thức của canxi cacbonat là
 Xem đáp án
Xem đáp án
Chọn D
Câu 27:
Dãy gồm các kim loại được xếp theo thứ tự tính khử tăng dần từ trái sang phải là
 Xem đáp án
Xem đáp án
Chọn B
Câu 31:
Ngâm một lá kẽm trong 100 ml dung dịch AgNO3 0,1M. Khi phản ứng kết thúc, khối lượng lá kẽm tăng thêm
 Xem đáp án
Xem đáp án
Zn + 2AgNO3 —> Zn(NO3)2 + 2Ag
0,005…..0,01……………………0,01
—> m tăng = mAg – mZn phản ứng = 0,755 gam
Chọn A
Câu 32:
Các dung dịch MgCl2 và AlCl3 đều không màu. Để phân biệt 2 dung dịch này có thể dùng dung dịch của chất nào sau đây?
 Xem đáp án
Xem đáp án
Dùng dung dịch NaOH từ từ tới dư:
+ Có kết tủa trắng là MgCl2:
MgCl2 + NaOH —> Mg(OH)2 + NaCl
+ Có kết tủa keo trắng sau tan là AlCl3:
AlCl3 + NaOH —> Al(OH)3 + NaCl
Al(OH)3 + NaOH —> NaAlO2 + H2O
Chọn A
Câu 33:
Để bảo quản natri, người ta phải ngâm natri trong
 Xem đáp án
Xem đáp án
Trong phòng thí nghiệm, kim loại Na được bảo quản bằng cách ngâm trong dầu hỏa vì dầu hỏa không tác dụng với Na, không hút ẩm, không hòa tan O2 nên ngăn Na tiếp xúc với môi trường bên ngoài.
Chọn D
Câu 34:
Hỗn hợp X gồm Mg và Al được chia làm hai phần bằng nhau. Phần 1: tan hết trong dung dịch HCl, thấy thoát ra 5,376 lít khí (đktc). Phần 2: tác dụng với dung dịch NaOH 1M thấy có 80 ml dung dịch đã phản ứng. Thành phần % theo số mol của Al trong hỗn hợp là
 Xem đáp án
Xem đáp án
Với NaOH, chỉ có Al phản ứng —> nAl = nNaOH = 0,08
Với HCl, cả Al và Mg đều phản ứng
—> nH2 = 1,5nAl + nMg = 0,24 —> nMg = 0,12
—> %nAl = 40%
Chọn A
Câu 35:
X là chất rắn màu trắng, dễ nghiền thành bột mịn, tạo được loại bột nhão có khả năng đông cứng nhanh khi nhào bột với nước; thường dùng để nặn tượng, đúc khuôn, bó bột khi gãy xương. Công thức hoá học của X là
 Xem đáp án
Xem đáp án
Chọn B
Câu 36:
Cho sơ đồ phản ứng sau:
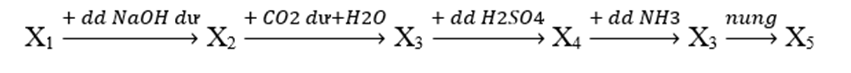
Biết X1, X2, X3, X4, X5 là các chất khác nhau của nguyên tố nhôm. Các chất X1 và X5 lần lượt là
 Xem đáp án
Xem đáp án
Theo sơ đồ thì X2 là NaAlO2; X3 là Al(OH)3
X4 là Al2(SO4)3; X5 là Al2O3
Từ X5 —> Loại A, C. Để các chất khác nhau thì chọn D.
Chọn D
Câu 37:
Nung m gam hỗn hợp X gồm KHCO3 và CaCO3 ở nhiệt độ cao đến khối lượng không đổi, thu được chất rắn Y. Cho Y vào nước dư, thu được 0,2m gam chất rắn Z và dung dịch E. Nhỏ từ từ dung dịch HCl 1M vào E, khi khí bắt đầu thoát ra cần dùng V1 lít dung dịch HCl và đến khi khí thoát ra vừa hết thì thể tích dung dịch HCl đã dùng là V2 lít. Tỉ lệ V1 : V2 tương ứng là:
 Xem đáp án
Xem đáp án
Tự chọn X gồm 2 mol KHCO3 và x mol CaCO3
—> Y gồm K2CO3 (1 mol) và CaO (x mol)
Hòa tan Y vào H2O
CaO + H2O —> Ca(OH)2
K2CO3 + Ca(OH)2 —> CaCO3 + 2KOH
—> Z là CaCO3 (x mol)
—> mZ = 100x = 0,2(100.2 + 100x)
—> x = 0,5
E chứa K2CO3 (1 – x = 0,5 mol) và KOH (1 mol)
Để khí bắt đầu xuất hiện thì: nH+ = 1 + 0,5 = 1,5
Để khí thoát ra hết thì: nH+ = 1 + 0,5.2 = 2
—> V1 : V2 = 1,5 : 2 = 3 : 4
Chọn D
Câu 38:
Cho các chất: Al, Al(OH)3, CuCl2, KHCO3. Số chất vừa tác dụng với dung dịch HCl, vừa tác dụng với dung dịch NaOH là
 Xem đáp án
Xem đáp án
Có 3 chất vừa tác dụng với dung dịch HCl, vừa tác dụng với dung dịch NaOH:
Al + HCl —> AlCl3 + H2
Al(OH)3 + HCl —> AlCl3 + H2O
KHCO3 + HCl —> KCl + CO2 + H2O
Al + NaOH + H2O —> NaAlO2 + H2
Al(OH)3 + NaOH —> NaAlO2 + H2O
KHCO3 + NaOH —> K2CO3 + Na2CO3 + H2O
CuCl2 tác dụng với NaOH nhưng không tác dụng với HCl.
Chọn C
Câu 39:
Cho 7,488 gam hỗn hợp rắn X gồm Fe, Fe3O4 và Fe(NO3)2 vào dung dịch chứa 0,3 mol HCl và 0,024 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn thu được dung dịch Y (không chứa NH4+) và 0,032 mol hỗn hợp khí Z gồm NO và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, sau phản ứng thấy thoát ra 0,009 mol NO (sản phẩm khử duy nhất của N+5), đồng thời thu được 44,022 gam kết tủa. Phần trăm khối lượng Fe trong hỗn hợp X có giá trị gần nhất với giá trị nào sau đây:
 Xem đáp án
Xem đáp án
Thêm AgNO3 vào Y thấy xuất hiện khí NO chứng tỏ Y chứa Fe2+, H+ dư và không có NO3-.
nAgCl = 0,3 —> nAg = 0,009
Bảo toàn electron: nFe2+ = 3nNO + nAg = 0,036
nH+ dư = 4nNO = 0,036
Dung dịch Y chứa Fe2+ (0,036), H+ dư (0,036), Cl- (0,3), bảo toàn điện tích —> nFe3+ = 0,064.
Ban đầu đặt a, b, c là số mol Fe, Fe3O4 và Fe(NO3)2
mX = 56a + 232b + 180c = 7,488 (1)
nFe = a + 3b + c = 0,036 + 0,064 (2)
nH+ phản ứng = 0,3 + 0,024 – 0,036 = 0,288
—> nH2O = 0,144
Bảo toàn O —> 4b + 6c + 0,024.3 = 0,032 + 0,144 (3)
(1)(2)(3) —> a = 0,05; b = 0,014; c = 0,008
—> %Fe = 37,39%
Chọn A
Câu 40:
Hỗn hợp X gồm Mg, Al, Al2O3 và MgCO3 (trong đó oxi chiếm 25,157% về khối lượng). Hòa tan hết 19,08 gam X trong dung dịch chứa 1,32 mol NaHSO4 và x mol HNO3, kết thúc phản ứng thu được dung dịch Y chỉ chứa các muối trung hòa có khối lượng 171,36 gam và hỗn hợp khí Z gồm CO2, N2O, H2. Tỉ khối của Z so với He bằng 7,5. Cho dung dịch NaOH dư vào Y, thu được 19,72 gam kết tủa. Giá trị của x là :
 Xem đáp án
Xem đáp án
nMg(OH)2 = 0,34
nO(X) = 0,3
Quy đổi hỗn hợp X thành Al (a), Mg (0,34), CO2 (b) và O(0,3 – 2b)
mX = 27a + 24.0,34 + 44b + 16(0,3 – 2b) = 19,08 (1)
Dung dịch muối chứa Al3+ (a), Mg2+ (0,34), NH4+ (c), Na+ (1,32) và SO42- (1,32)
Bảo toàn điện tích:
3a + 0,34.2 + c + 1,32 = 1,32.2 (2)
m muối = 27a + 24.0,34 + 18c + 23.1,32 + 96.1,32 = 171,36 (3)
Giải hệ (1)(2)(3): a = 0,2; b = 0,06; c = 0,04
Đặt u, v là số mol N2O và H2
m khí = 44u + 2v + 44.0,06 = 30(u + v + 0,06)
Bảo toàn electron:
8nN2O + 2nH2 + 8nNH4+ + 2nO(X) = 3nAl + 2nMg
—> 8u + 2v + 0,04.8 + 2.0,18 = 0,2.3 + 0,34.2
—> u = 0,06 và v = 0,06
Bảo toàn N:
nHNO3 = 2nN2O + nNH4+ = 0,16
Chọn C
