Thi Online (2023) Đề thi thử Hóa THPT Hoàng Hoa Thám, Hưng Yên (Lần 1) có đáp án
Thi Online (2023) Đề thi thử Hóa THPT Hoàng Hoa Thám, Hưng Yên (Lần 1) có đáp án
-
409 lượt thi
-
40 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 2:
Xà phòng hóa hoàn toàn 7,4 gam một este no, đơn chức, mạch hở cần dùng vừa đủ 100ml dung dịch NaOH 1M, thu được 6,8 gam muối khan. Công thức cấu tạo thu gọn của este là:
 Xem đáp án
Xem đáp án
n muối = nEste = nNaOH = 0,1
—> M este = 74: Este là C3H6O2
và M muối = 68: Muối là HCOONa
—> Cấu tạo este: HCOOC2H5
Chọn B
Câu 5:
Thủy phân 51,3 gam saccarozơ trong môi trường axit với hiệu suất 80%, thu được dung dịch X. Khối lượng glucozơ trong X là:
 Xem đáp án
Xem đáp án
Saccarozơ + H2O —> Glucozơ + Fructozơ
342……………………….180
51,3……………………….m
H = 80% —> mGlucozơ = 80%.51,3.180/342 = 21,6 gam
Chọn B
Câu 7:
Kim loại Fe tan hết trong lượng dư dung dịch nào sau đây?
 Xem đáp án
Xem đáp án
Kim loại Fe tan hết trong lượng dư dung dịch HCl:
Fe + 2HCl —> FeCl2 + H2
Fe không phản ứng với NaOH, Zn(NO3)2 và bị thụ động trong H2SO4 đặc, nguội.
Chọn D
Câu 9:
Nung m gam hỗn hợp A gồm Mg, FeCO3, FeS, Cu(NO3)2 (trong A % khối lượng oxi là 47,818%) một thời gian (muối nitrat bị nhiệt phân hoàn toàn) thì thu được chất rắn B và 11,144 lít hỗn hợp khí gồm CO2, NO2, O2, SO2. B phản ứng hoàn toàn với HNO3 đặc nóng dư (thấy có 0,67 mol HNO3 phản ứng) thu được dung dịch C và 3,136 lít hỗn hợp X gồm NO2 và CO2 (dX/H2 = 321/14). C tác dụng hoàn toàn với BaCl2 dư thấy xuất hiện 2,33 gam kết tủa. Biết các khí đo ở đktc. Giá trị gần nhất của m là?
 Xem đáp án
Xem đáp án
Đặt nO(A) = a
—> nO(B) = a – 2.0,4975 = a – 0,995 mol
nX = 0,14 mol chứa nNO2 = 0,13 và nCO2 = 0,01
Bảo toàn N —> nNO3- = 0,67 – 0,13 = 0,54
nSO42- = nBaSO4 = 0,01
nH2O = nHNO3/2 = 0,335
Bảo toàn O:
a – 0,995 + 0,67.3 = 0,54.3 + 0,01.4 + 0,14.2 + 0,335
—> a = 1,26
—> mO = 20,16
—> mA = 42,16 gam
Chọn D
Câu 10:
Trong dung dịch, ion nào sau đây oxi hóa được kim loại Cu?
 Xem đáp án
Xem đáp án
Trong dung dịch, ion Ag+ oxi hóa được kim loại Cu:
Ag+ + Cu —> Cu2+ + Ag
Chọn C
Câu 11:
Điện phân 600 ml dung dịch X chứa đồng thời NaCl 0,5M và CuSO4 aM (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước) đến khi thu được dung dịch Y có khối lượng giảm 24,25 gam so với khối lượng dung dịch X ban đầu thì ngừng điện phân. Nhúng một thanh sắt nặng 150 gam vào dung dịch Y đến khi các phản ứng xảy ra hoàn toàn, lấy thanh kim loại ra, rửa sạch, làm khô cân được 150,4 gam (giả thiết toàn bộ lượng kim loại tạo thành đều bám vào thanh sắt và không có sản phẩm khử của S+6 sinh ra). Giá trị của a là
 Xem đáp án
Xem đáp án
Y + Fe làm thanh Fe tăng lên nên Y còn Cu2+ dư.
nNaCl = 0,3
Anot: nCl2 = 0,15 và nO2 = x
Catot: nCu = y
Bảo toàn electron: 0,15.2 + 4x = 2y
m giảm = 0,15.71 + 32x + 64y = 24,25
—> x = 0,025 và y = 0,2
—> nH+ = 4x = 0,1
Đặt nCu2+ dư = z, bảo toàn electron:
2nFe = nH+ + 2nCu2+ —> nFe phản ứng = z + 0,05
—> 150 – 56(z + 0,05) + 64z = 150,4
—> z = 0,4
—> nCuSO4 ban đầu = y + z = 0,6
—> a = 1M
Chọn A
Câu 12:
Fe(NO3)2 thể hiện tính oxi hóa khi tác dụng với chất nào sau đây?
 Xem đáp án
Xem đáp án
Fe(NO3)2 thể hiện tính oxi hóa khi tác dụng với Mg:
Mg + Fe(NO3)2 —> Mg(NO3)2 + Fe (Số oxi hóa của Fe giảm từ +2 xuống 0)
Chọn B
Câu 14:
Khi làm thí nghiệm với dung dịch HNO3 đặc thường sinh ra khí nitơ đioxit gây ô nhiễm không khí. Công thức của nitơ đioxit là
 Xem đáp án
Xem đáp án
Công thức của nitơ đioxit là NO2.
Chọn C
Câu 15:
Hỗn hợp E gồm 2 triglixerit X và Y (cho biết MY > MX > 820 đvC). Cho m gam E tác dụng với dung dịch NaOH vừa đủ thu được ba muối natri panmitat, natrioleat và natri stearat theo đúng thứ tự về tỉ lệ mol là 2 : 2 : 1. Mặt khác m gam E tác dụng với H2 (xt Ni, t°) thu được 42,82 gam hỗn hợp G. Phần trăm khối lượng của X trong E gần nhất với
 Xem đáp án
Xem đáp án
Quy đổi E thành C15H31COOH (2e), C17H33COOH (2e), C17H35COOH (e); C3H5(OH)3 (5e/3), H2O (-5e)
mG = 256.2e + 284.3e + 92.5e/3 – 18.5e = 42,82
—> e = 0,03
nE = 5e/3 = 0,05 và C15H31COOH (0,06), C17H33COOH (0,06), C17H35COOH (0,03)
MY > MX > 820 nên không có (C15H31COO)3C3H5.
nC17H35COOH < nE nên C17H35COOH không thể xuất hiện ở cả X và Y.
Nếu C17H35COOH chỉ xuất hiện 1 lần ở 1 chất thì số mol các chất là 0,03 và 0,02:
—> X là (C17H35COO)(C15H31COO)2 (0,03)
và Y là (C17H33COO)3C3H5 (0,02)
—> %X = 58,59%
Nếu C17H35COOH xuất hiện 2 lần ở 1 chất thì số mol các chất là 0,015 và 0,035: Loại vì không xếp gốc axit vào chất béo 0,035 mol được.
Nếu C17H35COOH xuất hiện 3 lần ở 1 chất thì số mol các chất là 0,01 và 0,04: Loại, giống như trên.
Chọn A
Câu 17:
Khi lên men rượu m gam glucozơ (hiệu suất 100%) thu được 8,96 lít CO2 (đktc). Giá trị của m là:
 Xem đáp án
Xem đáp án
C6H12O6 —> 2C2H5OH + 2CO2
nCO2 = 0,4 —> nC6H12O6 = 0,2 —> mC6H12O6 = 36 gam
Chọn C
Câu 18:
Cho dãy các chất: Mg, Zn, Fe, Cu và Al. Số kim loại phản ứng với dung dịch HCl là:
 Xem đáp án
Xem đáp án
Có 4 kim loại phản ứng với dung dịch HCl là: Mg, Zn, Fe và Al.
Chọn D
Câu 20:
Trong phòng thí nghiệm, khí X được điều chế và thu vào bình tam giác như hình vẽ dưới đây
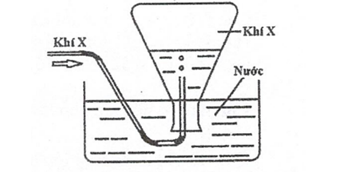
Trong các phản ứng dưới đây, phản ứng nào tạo ra chất không áp dụng được cách thu này?
 Xem đáp án
Xem đáp án
Khí X thu bằng phương pháp đẩy nước nên X không tan, không phản ứng với H2O —> Khí Cl2 không áp dụng cách này vì Cl2 tan trong nước và phản ứng một phần với H2O. Khí Cl2 thu bằng cách đẩy không khí.
Chọn A
Câu 21:
Cho các chất sau: acrilonitrin, buta-1,3-đien, benzen và etyl axetat. Có bao nhiêu chất tham gia phản ứng trùng hợp tạo thành polime?
 Xem đáp án
Xem đáp án
Có 2 chất tham gia phản ứng trùng hợp tạo thành polime là acrilonitrin (CH2=CH-CN) và buta-1,3-đien (CH2=CH-CH=CH2)
Chọn D
Câu 22:
Tiến hành thí nghiệm theo các bước sau:
- Bước 1: Rót vào 2 ống nghiệm, mỗi ống khoảng 3 ml dung dịch H2SO4 loãng cùng nồng độ và cho vào mỗi ống một mẩu kẽm như nhau.
- Bước 2: Nhỏ thêm vài giọt dung dịch CuSO4 vào ống nghiệm thứ nhất.
Cho các nhận định sau:
(a) Ở bước 1, xảy ra hiện tượng ăn mòn hóa học, lượng khí thoát ra từ mỗi ống nghiệm đều như nhau.
(b) Ở bước 2, ống nghiệm thứ nhất xảy ra sự ăn mòn điện hóa do Zn khử Cu tạo thành cặp điện cực Zn-Cu.
(c) Khi cho thêm vài giọt muối CuSO4 vào ống nghiệm thứ nhất, thấy bọt khí thoát ra nhanh hơn so với ống nghiệm thứ hai.
(d) Ở bước 2, có thể thay dung dịch CuSO4 bằng dung dịch MgSO4 thì hiện tượng xảy ra tương tự.
(e) Nếu thay mẩu kẽm bằng mẩu sắt thì tốc độ giải phóng khí sẽ chậm hơn.
(f) Ở bước 1, Zn bị khử thành Zn2+
Số nhận định đúng là:
 Xem đáp án
Xem đáp án
(a) Đúng, do điều kiện ban đầu như nhau (H2SO4 loãng cùng nồng độ, cùng thể tích và mẩu Zn như nhau) nên khí thoát ra từ mỗi ống nghiệm đều như nhau và Zn bị ăn mòn hóa học:
Zn + H2SO4 —> ZnSO4 + H2
(b) Sai, do Zn khử Cu2+ tạo thành cặp điện cực Zn-Cu nên có ăn mòn điện hóa.
(c) Đúng, khi có ăn mòn điện hóa, Zn bị ăn mòn nhanh hơn làm khí thoát ra nhanh hơn.
(d) Sai, do Zn không khử được Mg2+ nên nếu thay CuSO4 bằng MgSO4 thì không có ăn mòn điện hóa.
(e) Đúng, do Fe có tính khử yếu hơn Zn nên phản ứng kém hơn Zn.
(f) Sai, Zn bị oxi hóa thành Zn2+.
Chọn D
Câu 23:
Glucozơ là chất dinh dưỡng và được dùng làm thuốc tăng lực cho người già, trẻ em và người ốm. Công thức phân tử của glucozơ là:
 Xem đáp án
Xem đáp án
Chọn D
Câu 24:
Cho các phát biểu sau
(a) Điện phân dung dịch CaCl2, thu được Ca ở catot.
(b) Than hoạt tính được sử dụng nhiều trong mặt nạ phòng độc, khẩu trang y tế.
(c) Cho Ba(HCO3)2 vào dung dịch KHSO4 sinh ra kết tủa và khí.
(d) Cho lá Fe vào dung dịch gồm CuSO4 và H2SO4 xảy ra ăn mòn điện hóa.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Sai, thu được H2 ở catot:
CaCl2 + H2O —> H2 + Cl2 + Ca(OH)2
(b) Đúng
(c) Đúng: KHSO4 + Ba(HCO3)2 —> BaSO4 + K2SO4 + CO2 + H2O
(d) Đúng: Fe + CuSO4 —> FeSO4 + Cu
CU sinh ra bám vào lá Fe làm xuất hiện cặp điện cực Fe-Cu cùng tiếp xúc với dung dịch điện li nên có ăn mòn điện hóa.
Chọn B
Câu 27:
Đốt cháy hoàn toàn 3,1 gam một amin no, đơn chức, mạch hở X cần thu được 4,4 gam CO2. Tên gọi của X là:
 Xem đáp án
Xem đáp án
nCO2 = 0,1 —> nCxH2x+3N = 0,1/x
—> M = 14x + 17 = 3,1x/0,1
—> x = 1: Amin là CH3NH2 (Metylamin)
Chọn C
Câu 28:
Cho các phát biểu sau:
(a) Chất béo nhẹ hơn nước và không tan trong nước.
(b) Rửa ống nghiệm có dính anilin bằng dung dịch HCl.
(c) Trong phân tử peptit mạch hở Gly-Ala-Glu có 4 nguyên tử oxi.
(d) Glucozơ và fructozơ đều thuộc loại monosaccarit.
(e) Các este bị thủy phân trong môi trường kiềm đều tạo muối và ancol.
(g) Ở điều kiện thường, amino axit là những chất lỏng dễ tan trong nước.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng
(b) Đúng, do anilin tạo muối tan C6H5NH3Cl dễ rửa trôi
(c) Sai, có 6 oxi
(d) Đúng
(e) Sai, tùy loại este
(g) Sai, chất rắn kết tinh ở điều kiện thường
Chọn B
Câu 30:
X là kim loại có nhiệt độ nóng chảy cao nhất trong tất cả các kim loại. X là
 Xem đáp án
Xem đáp án
Chọn D
Câu 31:
Dẫn khí H2 qua chất rắn X nung nóng thu được chất rắn Y có khối lượng nhỏ hơn khối lượng của X. Cho Y tác dụng với dung dịch HCl dư thu được dung dịch Z và phần không tan T. X là:
 Xem đáp án
Xem đáp án
mY < mX nên H2 có khử được X.
Y tan một phần trong HCl dư nên chọn X là CuO.
Y gồm Cu và CuO dư, chỉ CuO dư tan trong HCl, còn lại phần không tan T là Cu.
Chọn C
Câu 32:
Khử hoàn toàn 8 gam CuO bằng CO thu được m gam rắn. Giá trị của m là:
 Xem đáp án
Xem đáp án
CuO + CO —> Cu + CO2
nCu = nCuO = 0,1 —> mCu = 6,4 gam
Chọn C
Câu 33:
Cho chất X tác dụng với HCl trong dung dịch tạo ra khí H2. Chất X là:
 Xem đáp án
Xem đáp án
A. Mg + 2HCl —> MgCl2 + H2
B. CaCO3 + 2HCl —> CaCl2 + CO2 + H2O
C. NaHCO3 + HCl —> NaCl + CO2 + H2O
D. Fe2O3 + 6HCl —> 2FeCl3 + 3H2O
Chọn A
Câu 34:
Crackinh hoàn toàn V lít ankan X thu được hỗn hợp Y gồm 0,1V lít C3H8; 0,5V lít CH4 và 1,9V lít các hiđrocacbon khác, tỉ khối của Y so với H2 bằng 14,4. Dẫn 21,6 gam Y đi qua bình chứa dung dịch brom (dư), phản ứng kết thúc thấy khối lượng bình tăng m gam. Biết các thể tích khí đo ở cùng điều kiện, chỉ có ankan tham gia phản ứng crackinh. Giá trị của m là
 Xem đáp án
Xem đáp án
MY = 28,8 —> nY = 0,75
nX : nY = V : 2,5V = 1 : 2,5 —> nX = 0,3
nX : nY = MY : MX —> MX = 72: X là C5H12
nAnkan không thay đổi khi cracking nên: Y chứa ankan (0,3 mol)
Phần ankan trong Y bao gồm: C3H8 (0,03 mol), CH4 (0,15 mol) —> C2H6 (0,3 – 0,03 – 0,15 = 0,12 mol)
m tăng = m anken = mX – m ankan trong Y = 14,28 gam
Chọn B
Câu 35:
Dẫn 8,96 lít khí CO2 (đktc) vào dung dịch Ca(OH)2 dư. Phản ứng kết thúc thu được m gam tủa. Giá trị của m là:
 Xem đáp án
Xem đáp án
CO2 + Ca(OH)2 dư —> CaCO3 + H2O
—> nCaCO3 = nCO2 = 0,4 —> mCaCO3 = 40 gam
Chọn B
Câu 38:
(đun nóng), thu được sản phẩm hữu cơ gồm:
 Xem đáp án
Xem đáp án
CH3COOC2H5 + NaOH —> CH3COONa + C2H5OH
CH3COOCH=CH2 + NaOH —> CH3COONa + CH3CHO
—> Sản phẩm hữu cơ gồm: 1 muối, 1 ancol và 1 anđehit.
Chọn C
Câu 39:
X là este no, đa chức, mạch hở; Y là este ba chức, mạch hở (được tạo bởi glixerol và một axit cacboxylic đơn chức, không no chứa một liên kết C=C). Đốt cháy hoàn toàn 17,02 gam hỗn hợp E chứa X, Y thu được 18,144 lít CO2 (đktc). Mặt khác đun nóng 0,12 mol E cần dùng 570 ml dung dịch NaOH 0,5M thu được dung dịch G. Cô cạn dung dịch G thu được hỗn hợp T chứa 3 muối (T1, T2, T3) và hỗn hợp 2 ancol có cùng số nguyên tử cacbon. Biết MT1 < MT2 < MT3 và T3 nhiều hơn T1 là 2 nguyên tử cacbon. Phần trăm khối lượng của T3 trong hỗn hợp T gần nhất với giá trị nào dưới đây?
 Xem đáp án
Xem đáp án
Với NaOH:
nE = nX + nY = 0,12
nNaOH = 2nX + 3nY = 0,285
—> nX = 0,075 và nY = 0,045
—> nX : nY = 5 : 3
X là CnH2n-2O4: 5a mol
Y là CmH2m-10O6: 3a mol
—> 5a(14n + 62) + 3a(14m + 86) = 17,02 (1)
nCO2 = 5na + 3ma = 0,81 (2)
(1) – (2).14 —> a = 0,01
(2) —> 5n + 3m = 81
Do n ≥ 6 và m ≥ 12 và m lấy các giá trị 12, 15, 18… nên n = 9 và m = 12 là nghiệm duy nhất.
Sản phẩm xà phòng hóa gồm 3 muối T1, T2, T3; MT1 < MT2 < MT3 và T3 nhiều hơn T1 là 2 nguyên tử cacbon nên cấu tạo các este là:
X là CH3COO-C3H6-OOC-C3H7 (0,05 mol)
Y là (CH2=CH-COO)3C3H5 (0,03 mol)
(Thủy phân 0,08 mol E hay 0,12 mol E thì %muối có giá trị không đổi)
Các muối gồm:
T1 là CH3COONa (0,05)
T2 là CH2=CH-COONa (0,09)
T3 là C3H7COONa (0,05) —> %T3 = 30,45%
Chọn B
Câu 40:
Cho sơ đồ chuyển hóa: X → Na → Y → Z → X. Biết: X, Y, Z là các hợp chất khác nhau của natri; mỗi mũi tên ứng với một phương trình hóa học. Cho các cặp chất sau:
(a) NaCl và Na2CO3. (b) NaCl và KHSO4.
(c) NaOH và Na2SO4. (d) NaOH và NaHCO3.
Số cặp chất thỏa mãn hai chất X và Z trong sơ đồ chuyển hóa trên là:
 Xem đáp án
Xem đáp án
Có 3 cặp chất thỏa mãn là (a), (c), (d):
(a) NaCl → Na → NaOH → Na2CO3 → NaCl
(Điện phân nóng chảy, cộng H2O, cộng CO2, cộng HCl)
(c) NaOH → Na → Na2S → Na2SO4 → NaOH
(Điện phân nóng chảy, cộng S, cộng H2SO4, cộng Ba(OH)2)
(d) NaOH → Na → C6H5ONa → NaHCO3 → NaOH
(Điện phân nóng chảy, cộng C6H5OH, cộng CO2, cộng Ba(OH)2)
Chọn D
