Thi Online (2023) Đề thi thử Hóa học Sở giáo dục và đào tạo Bắc Giang (Lần 1) có đáp án
Thi Online (2023) Đề thi thử Hóa học Sở giáo dục và đào tạo Bắc Giang (Lần 1) có đáp án
-
415 lượt thi
-
40 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Dung dịch Na2CO3 tác dụng được với dung dịch chất nào sau đây?
 Xem đáp án
Xem đáp án
Dung dịch Na2CO3 tác dụng được với dung dịch BaCl2:
Na2CO3 + BaCl2 → BaCO3 + 2NaCl
Câu 2:
Phản ứng nào sau đây là phản ứng nhiệt nhôm?
 Xem đáp án
Xem đáp án
Phản ứng nhiệt nhôm là phản ứng giữa Al và oxit kim loại → A là phản ứng nhiệt nhôm.
Câu 4:
Một mẫu nước cứng có chứa các ion: Ca2+, Mg2+, Cl- và SO42-. Dùng dung dịch chất nào sau đây để làm mềm mẫu nước cứng trên?
 Xem đáp án
Xem đáp án
Dùng dung dịch Na3PO4 để làm mềm mẫu nước cứng trên:
Ca2+ + PO43- → Ca3(PO4)2
Mg2+ + PO43- → Mg3(PO4)2
Câu 9:
Sản phẩm trùng hợp của monome nào sau đây được sử dụng để chế tạo tơ nitron (olon)?
 Xem đáp án
Xem đáp án
Chọn C
Câu 16:
Trong công nghiệp, điều chế NaOH bằng cách điện phân dung dịch chất X (có màng ngăn xốp). Chất X là
 Xem đáp án
Xem đáp án
Chọn A
Câu 19:
Dung dịch etylamin không phản ứng với chất nào sau đây?
 Xem đáp án
Xem đáp án
A. H2SO4 + C2H5NH2 → C2H5NH3HSO4
B. HCl + C2H5NH2 → C2H5NH3Cl
C. HNO3 + C2H5NH2 → C2H5NH3NO3
D. Không phản ứng.
Câu 20:
Trong công nghiệp, khí X và NH3 được dùng để sản xuất phân urê. Sự tăng nồng độ của X trong khí quyển là nguyên nhân chủ yếu gây “hiệu ứng nhà kính”. Khí X là
 Xem đáp án
Xem đáp án
X là CO2:
CO2 + NH3 → (NH2)2CO + H2O
CO2 là nguyên nhân chủ yếu gây “hiệu ứng nhà kính”.
Câu 21:
Từ 1 tấn nguyên liệu chứa 80% tinh bột, bằng phương pháp lên men (các chất còn lại trong nguyên liệu không lên men) sản xuất được V lít cồn 90°. Biết rằng sự hao hụt trong toàn bộ quá trình là 20%, khối lượng riêng của ancol etylic là 0,8 gam/ml. Giá trị của V là
 Xem đáp án
Xem đáp án
(C6H10O5)n → nC6H12O6 → 2nC2H5OH
mC6H10O5 = 1000.80% = 800 kg
→ mC2H5OH = 800.2.46.80%/162 = 363,4568 kg
→ V = 363,4568/0,8.90% = 504,8 lít
Câu 22:
Cho 0,3 gam kim loại R phản ứng hết với dung dịch HCl (dư), thu được 0,28 lít khí H2 (đktc). Kim loại R là
 Xem đáp án
Xem đáp án
nH2 = 0,0125
Kim loại R hóa trị x, bảo toàn electron:
0,3x/R = 0,0125.2 → R = 12x
→ x = 2, R = 24: R là Mg
Câu 23:
Phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
A. Sai, Al thụ động trong dung dịch H2SO4 đặc, nguội nên không tan.
B. Đúng, dùng Ba(OH)2 dư, AlCl3 có kết tủa keo trắng, sau tan, Na2SO4 có kết tủa trắng.
C. Sai, ở nhiệt độ cao, NaOH không bị phân hủy, Al(OH)3 bị phân hủy thành Al2O3, H2O.
D. Sai, Cu không khử được Fe2+.
Câu 24:
Este X mạch hở có công thức phân tử C4H6O2. Đun nóng 1 mol X trong dung dịch KOH (vừa đủ), thu được dung dịch Y. Cho toàn bộ Y tác dụng với lượng dư dung dịch AgNO3 trong NH3, thu được tối đa 4 mol Ag. Biết các phản ứng xảy ra hoàn toàn. Công thức cấu tạo của X là
 Xem đáp án
Xem đáp án
Cho Y phản ứng tráng gương thu được tối đa 4 mol Ag nên Y chứa 2 chất đều tham gia phản ứng tráng gương.
→ X là HCOOCH=CH-CH3
Y chứa HCOOK và C2H5CHO.Câu 25:
Thuỷ phân hoàn toàn tinh bột trong dung dịch axit vô cơ loãng, thu được chất hữu cơ X. Cho X phản ứng với khí H2 (xúc tác Ni, t°), thu được chất hữu cơ Y. Các chất X, Y lần lượt là
 Xem đáp án
Xem đáp án
Các chất X, Y lần lượt là glucozơ, sobitol.
(C6H10O5)n + nH2O → nC6H12O6
C6H12O6 + H2 → C6H14O6
Câu 26:
Cho m gam axit glutamic (HOOC-[CH2]2-CH(NH2)-COOH) phản ứng hết với dung dịch KOH (dư), thu được dung dịch chứa 17,84 gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Glu + 2KOH → GluK2 + 2H2O
nGlu = nGluK2 = 0,08 → mGlu = 11,76 gam
Câu 27:
Nung hỗn hợp X gồm các chất Fe(NO3)2, Fe(OH)2 và FeCO3 trong không khí đến khối lượng không đổi, thu được một chất rắn Y. Chất rắn Y là
 Xem đáp án
Xem đáp án
Y là Fe2O3:
Fe(NO3)2 → Fe2O3 + NO2 + O2
Fe(OH)2 + O2 → Fe2O3 + H2O
FeCO3 + O2 → Fe2O3 + CO2
Câu 28:
Đốt cháy 3,38 gam hỗn hợp gồm Zn, Al và Mg trong khí O2 (dư), thu được 4,66 gam hỗn hợp oxit X. Để hòa tan hoàn toàn lượng X trên, cần dùng vừa đủ V ml dung dịch HCl 0,5M. Giá trị của V là
 Xem đáp án
Xem đáp án
nH2O = nO = (mX – m kim loại)/16 = 0,08
Bảo toàn H → nHCl = 2nH2O = 0,16
→ VddHCl = 320 ml
Câu 29:
Cho 10,56 gam etyl axetat vào 120 ml dung dịch NaOH 0,2M, sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch X. Cô cạn X, thu được m gam chất rắn khan. Giá trị của m là
 Xem đáp án
Xem đáp án
CH3COOC2H5 + NaOH → CH3COONa + C2H5OH
nCH3COOC2H5 = 0,12; nNaOH = 0,024
→ Chất rắn là CH3COONa (0,024) → m = 1,968 gam
Câu 30:
Cho các loại tơ: tơ capron, tơ xenlulozơ axetat, tơ tằm, tơ nitron, nilon-6,6. Số tơ tổng hợp là
 Xem đáp án
Xem đáp án
Các tơ tổng hợp trong dãy: tơ capron, tơ nitron, nilon-6,6.
Câu 31:
Cho các phát biểu sau:
(a) Dầu thực vật và dầu bôi trơn máy đều có thành phần chính là chất béo.
(b) Nước ép của quả nho chín có khả năng tham gia phản ứng tráng bạc.
(c) Nhỏ dung dịch brom vào dung dịch phenol (dư), thấy xuất hiện kết tủa màu trắng.
(d) Trong phân tử peptit mạch hở Gly-Ala-Gly có bốn nguyên tử oxi.
(e) Hợp chất hữu cơ nhất thiết phải có cacbon và hiđro.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Sai, thành phần chính của dầu thực vật là chất béo, của dầu bôi trơn là hidrocacbon.
(b) Đúng, nước ép nho chín chứa glucozơ nên có khả năng tham gia phản ứng tráng bạc.
(c) Đúng
(d) Đúng, Gly-Ala-Gly là C7H13N3O4
(e) Sai, hợp chất hữu cơ nhất thiết phải có cacbon, không nhất thiết có hiđro.
Câu 32:
Điện phân dung dịch chứa hỗn hợp gồm CuSO4 và KCl với cường độ dòng điện không đổi 2,5A (điện cực trơ, có màng ngăn xốp, hiệu suất điện phân là 100%). Kết quả thí nghiệm như sau:
|
Thời gian điện phân (giây) |
t |
t + 6755 |
3t |
|
Tổng số mol khí ở hai điện cực |
x |
x + 0,09375 |
3,5x |
|
Số mol Cu ở catot |
x |
x + 0,05 |
x + 0,05 |
Giá trị của t là
 Xem đáp án
Xem đáp án
Trong khoảng thời gian 6755s (tính từ t đến t + 6755) có ne = 6755.2,5/F = 0,175
Catot: nCu = 0,05 → nH2 = 0,0375
Anot: nCl2 = u, nO2 = v
—-> 2u + 4v = 0,175 và u + v + 0,0375 = 0,09375
→ u = 0,025; v = 0,03125
ne trong t giây = 2x → ne trong 3t giây = 6x
Catot: nCu = x + 0,05 → nH2 = 2x – 0,05
Anot: nCl2 = x + 0,025 → nO2 = x – 0,0125
n khí tổng = 2x – 0,05 + x + 0,025 + x – 0,0125 = 3,5x
→ x = 0,075
ne trong t giây = 2x = It/F → t = 5790s
Câu 33:
Vải Thiều Lục Ngạn (Bắc Giang) là loại quả mang giá trị dinh dưỡng và kinh tế cao. Theo tính toán của một nhà vườn, cứ thu được 100 kg quả vải thì cần cung cấp khoảng 1,84 kg nitơ, 0,62 kg photpho và 1,26 kg kali, để bù lại cho cây phục hồi, sinh trưởng và phát triển. Trong một vụ thu hoạch, nhà vườn đã thu được 10 tấn quả vải và đã dùng hết x kg phân bón NPK (20 – 20 – 15) trộn với y kg phân KCl (độ dinh dưỡng 60%) và z kg urê (độ dinh dưỡng 46%) để bù lại cho cây. Tổng giá trị (x + y + z) gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Lượng dinh dưỡng cần cung cấp để thu hoạch 10 tấn vải gồm 184 kg nitơ, 62 kg photpho và 126 kg kali.
mN = 184 = 20%x + 46%z
mP = 62 = 20%x.2.31/142
mK = 126 = 15%x.2.39/94 + 60%y.2.39/94
→ x = 710; y = 75,58; z = 91,30
→ x + y + z = 876,9
Câu 34:
Cho sơ đồ phản ứng sau:
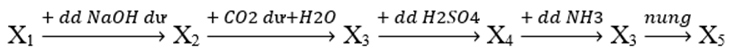
Biết X1, X2, X3, X4, X5 là các hợp chất khác nhau của nguyên tố nhôm. Trong các chất Al, Al2O3, Al(OH)3, AlCl3 và Al2(SO4)3, số chất thỏa mãn X1 là
 Xem đáp án
Xem đáp án
Theo sơ đồ thì X2 là NaAlO2; X3 là Al(OH)3; X4 là Al2(SO4)3; X5 là Al2O3
X1, X2, X3, X4, X5 là các hợp chất khác nhau nên X1 có thể là Al, AlCl3
Câu 35:
Cho E và F là các chất hữu cơ mạch hở, đều có công thức phân tử C4H6O4. Cho các chuyển hóa sau:
(1) E + NaOH → X + Y + H2O
(2) F + NaOH → Z + T + H2O
(3) X + HCl → R + NaCl
(4) Z + CO → R
Biết X, Y, Z, T, R là các hợp chất hữu cơ. Cho các phát biểu sau:
(a) E, F là hợp chất hữu cơ tạp chức.
(b) Y phản ứng với NaOH/CaO, t° thu được CH4.
(c) R là axit fomic.
(d) X, Y, T đều là muối của axit cacboxylic.
(e) Ở điều kiện thích hợp Z tác dụng được với Na, C2H5OH, HBr.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(1)(2) tạo H2O nên E, F có COOH.
(4) → Z là CH3OH, R là CH3COOH
(3) → X là CH3COONa
(1) → E là CH3COO-CH2-COOH; Y là HO-CH2-COONa
(2) → F là HOOC-CH2-COOCH3; T là CH2(COONa)2
(a) Đúng, E, F đều chứa các chức este, axit.
(b) Sai, HO-CH2-COONa + NaOH → CH3OH + Na2CO3
(c) Sai, R là axit axetic.
(d) Sai, T không phải muối của axit cacboxylic.
(e) Đúng, Z + Na, C2H5OH, HBr tạo sản phẩm tương ứng là CH3ONa, CH3OC2H5 và CH3Br.
Câu 36:
Đốt cháy hoàn toàn 0,08 mol hỗn hợp X gồm CH4, C2H2, C2H4 và C2H6, thu được 3,136 lít khí CO2 (đktc) và 3,06 gam H2O. Mặt khác, 10,1 gam X phản ứng tối đa với a mol Br2 trong dung dịch. Giá trị của a là
 Xem đáp án
Xem đáp án
nCO2 = 0,14; nH2O = 0,17
nX = 0,08 = (nH2O + nBr2) – nCO2
→ nBr2 = 0,05
mX = mC + mH = 2,02 gam
→ 10,1 gam phản ứng tối đa 0,05.10,1/2,02 = 0,25 mol Br2
Câu 37:
Tiến hành các thí nghiệm sau:
(a) Cho dung dịch NaOH vào dung dịch Ca(HCO3)2.
(b) Cho dung dịch CH3NH2 tới dư vào dung dịch FeCl3.
(c) Sục khí H2S vào dung dịch FeCl2.
(d) Sục khí NH3 tới dư vào dung dịch AlCl3.
(e) Sục khí etilen vào dung dịch KMnO4.
Sau khi các phản ứng kết thúc, có bao nhiêu thí nghiệm thu được kết tủa?
 Xem đáp án
Xem đáp án
(a) NaOH + Ca(HCO3)2 → CaCO3 + Na2CO3 + H2O
(b) CH3NH2 + H2O + FeCl3 → Fe(OH)3 + CH3NH3Cl
(c) Không phản ứng
(d) NH3 + AlCl3 + H2O → Al(OH)3 + NH4Cl
(e) C2H4 + KMnO4 + H2O → C2H4(OH)2 + MnO2 + KOH
Câu 38:
Đốt cháy hoàn toàn 8,58 gam triglixerit X, thu được H2O và 0,55 mol CO2. Nếu cho 25,74 gam X tác dụng với dung dịch NaOH (vừa đủ), thu được glixerol và m gam muối. Mặt khác, 38,61 gam X tác dụng được tối đa với 0,09 mol Br2 trong dung dịch. Kết luận nào sau đây không đúng?
 Xem đáp án
Xem đáp án
nBr2 phản ứng với 8,58 gam X = 0,09.8,58/38,61 = 0,02 mol
Quy đổi 8,58 gam X thành (HCOO)3C3H5 (x), CH2 (y) và H2 (-0,02)
mX = 176x + 14y – 0,02.2 = 8,58
nCO2 = 6x + y = 0,55
→ x = 0,01; y = 0,49
A. Đúng: nX : nBr2 = 1 : 2 nên X có 5 liên kết π (2C=C + 3C=O)
B. Sai, số C = nCO2/nX = 55
C. Đúng, muối gồm HCOONa (3x), CH2 (y) và H2 (-0,02)
→ m muối = 8,86
→ Từ 25,74 gam X thu được m muối = 26,58 gam.
D. Đúng: nH2O = 4x + y – 0,02 = 0,51
→ Từ 25,74 gam X thu được nH2O = 1,53 mol
Câu 39:
Hòa tan hết m gam hỗn hợp X gồm Fe, FeO, Fe2O3 và Fe3O4 vào dung dịch HCl (dư), thu được a mol H2 và dung dịch chứa 31,19 gam hỗn hợp muối. Mặt khác, hòa tan hoàn toàn m gam X trong dung dịch chứa 0,55 mol H2SO4 (đặc) đun nóng, thu được dung dịch Y và 0,14 mol SO2 (sản phẩm khử duy nhất của S+6). Cho 400 ml dung dịch NaOH 1M vào Y, sau khi phản ứng kết thúc, thu được 10,7 gam kết tủa. Giá trị của a là
 Xem đáp án
Xem đáp án
nNaOH = 0,4 và nFe(OH)3 = 0,1
→ nH+ dư = 0,4 – 0,1.3 = 0,1
Bảo toàn S → nSO42-(Y) = 0,55 – 0,14 = 0,41
Y chứa H+ (0,1), SO42- (0,41), bảo toàn điện tích → nFe3+ = 0,24
Bảo toàn electron: 0,24.3 = 2nO + 2nSO2
→ nO = 0,22
Trong phản ứng với HCl có nH2O = nO = 0,22
Bảo toàn H → nHCl phản ứng = 2a + 0,44
→ m muối = 0,24.56 + 35,5(2a + 0,44) = 31,19
→ a = 0,03
Câu 40:
Hỗn hợp E gồm X, Y và T (X, Y là hai axit cacboxylic đơn chức, mạch hở (MX < MY); T là este hai chức tạo bởi X, Y và một ancol no, mạch hở Z). Đốt cháy hoàn toàn 6,88 gam E bằng một lượng O2 (vừa đủ), thu được 5,6 lít CO2 (đktc) và 3,24 gam H2O. Khi cho 3,44 gam E tác dụng với lượng dư dung dịch AgNO3 trong NH3, thu được 6,48 gam Ag. Mặt khác, cho 6,88 gam E tác dụng với 150 ml dung dịch KOH 1M, cô cạn hỗn hợp sau phản ứng thu được m gam chất rắn khan. Giá trị của m là
 Xem đáp án
Xem đáp án
nCO2 = 0,25; nH2O = 0,18
nO(E) = (mE – mC – mH)/16 = 0,22
E tráng gương nên X là HCOOH, từ 6,88 gam E tạo nAg = 0,12
E gồm HCOOH (x), RCOOH (y) và (HCOO)(RCOO)A (z)
nO(E) = 2x + 2y + 4z = 0,22 (1)
nAg = 2x + 2z = 0,12 (2)
Nếu Y có k = 1 thì z = nCO2 – nH2O = 0,07: Vô lí vì mâu thuẫn với (1), (2).
Nếu Y có k = 2 thì nCO2 – nH2O = 0,07 = y + 2z
Kết hợp (1)(2) → x = 0,04; y = 0,03; z = 0,02
Nếu Y có k = 3 thì nCO2 – nH2O = 0,07 = 2y + 3z
Kết hợp (1)(2) → Vô nghiệm
Vậy k ≥ 3 thì hệ vô nghiệm.
nCO2 = 0,04.1 + 0,03CY + 0,02(CY + CZ + 1) = 0,25
→ 5CY + 2CZ = 19
Với CY ≥ 3 và CZ ≥ 2 → CY = 3, CZ = 2 là nghiệm duy nhất.
nKOH = 0,15 → Chất rắn gồm HCOOK (0,06), C2H3COOK (0,05) và KOH dư (0,04)
→ m rắn = 12,78
