Đề kiểm tra Hóa 11 học kì 1 có đáp án (đề 10)
-
2725 lượt thi
-
23 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Silic đioxit (SiO2) tan được trong dung dịch của chất nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án A
Silic đioxit (SiO2) tan được trong dung dịch axit HF.
Phương trình hóa học:
SiO2 + 4HF → SiF4 + 2H2O
Câu 2:
Một loại nước thải công nghiệp có pH = 9. Nước thải đó có môi trường
 Xem đáp án
Xem đáp án
Đáp án A
pH = 9 > 7 ⟹ Nước thải có môi trường bazơ.
Câu 3:
Hoà tan hoàn toàn m gam Al vào dung dịch HNO3 loãng, thu được dung dịch Y chứa 8m gam muối và x mol một chất khí duy nhất là N2O. Cho dung dịch NaOH dư vào Y, kết thúc thí nghiệm có 64,6 gam NaOH đã phản ứng. Giá trị của x gần nhất với
 Xem đáp án
Xem đáp án
Đáp án B
Giả sử dung dịch sau phản ứng chỉ có muối nhôm.
⟹ Khối lượng khối là: ⟹ Dung dịch còn chứa thêm muối NH4NO3.
⟹ Số mol của NH4NO3 là: (mol)
Bảo toàn electron ta có: (1)
Bảo toàn Na ta có: ⟹ m ≈ 10,801 gam
Thay vào (1) ⟹ x ≈ 0,13516
Câu 4:
 Xem đáp án
Xem đáp án
Đáp án A
Khí X không màu, không mùi, rất độc nhưng được dùng trong luyện kim để khử các oxit kim loại.
⟹ Khí X là khí CO.
Câu 5:
Nhỏ từ từ dung dịch HNO3 đến dư vào dung dịch NH4HCO3, hiện tượng xảy ra là
 Xem đáp án
Xem đáp án
Đáp án B
Nhỏ từ từ dung dịch HNO3 đến dư vào dung dịch NH4HCO3, hiện tượng xảy ra là thoát ra khí không màu.
Phương trình hóa học:
HNO3 + NH4HCO3 → NH4NO3 + CO2↑ + H2O
Câu 6:
Khi thực hiện phản ứng giữa dung dịch HNO3 đặc với kim loại sinh ra khí NO2 độc hại. Để hạn chế khí NO2 thoát ra gây ô nhiễm môi trường, ta phải đậy ống nghiệm bằng bông tẩm
 Xem đáp án
Xem đáp án
Đáp án B
Để ngăn khí độc ta dùng hóa chất phản ứng với khí đó tạo thành chất không độc.
Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là dùng bông có tẩm nước vôi trong để nút vào ống nghiệm.
2Ca(OH)2 + 4NO2 → Ca(NO3)2 + Ca(NO2)2 + 2H2O
Câu 7:
Thực hiện thí nghiệm với hai mẫu photpho X và Y như hình vẽ:
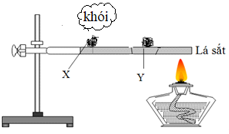
Mẫu X là
 Xem đáp án
Xem đáp án
Đáp án A
Photpho trắng dễ bị bốc cháy hơn photpho đỏ.
Câu 8:
Phân urê cung cấp cho cây trồng nguyên tố dinh dưỡng gì?
 Xem đáp án
Xem đáp án
Đáp án A
Phân urê cung cấp cho cây trồng nguyên tố dinh dưỡng nitơ.
Câu 9:
 Xem đáp án
Xem đáp án
Đáp án D
Amoniac có công thức hóa học là NH3.
Câu 10:
Chất nào sau đây là chất điện li yếu?
 Xem đáp án
Xem đáp án
Đáp án A
Chất điện li yếu là H3PO4. Phân li theo ba nấc.
Phương trình điện li:
Câu 11:
 Xem đáp án
Xem đáp án
Đáp án B
Ta có:
⟹ tấn
Do hiệu suất chỉ đạt 96% ⟹ Khối lượng HNO3 thực tế thu được là:
m = ≈ 7,1153 tấn
Khối lượng dung dịch HNO3 60% thu được là:
mdd = tấn
Câu 13:
Dung dịch X gồm 0,05 mol K+, 0,04 mol , 0,03 mol Cl- và . Cô cạn dung dịch X, thu được m gam chất rắn khan. Giá trị của m là:
 Xem đáp án
Xem đáp án
Đáp án B
Bảo toàn điện tích ta có:
Khối lượng chất rắn khan là:
m = 0,05.39 + 0,04.35,5 + 0,03.60 + 0,05.18 = 6,07 gam
Câu 14:
Phản ứng Ba(OH)2 + 2HCl → BaCl2 + 2H2O có phương trình ion thu gọn là:
 Xem đáp án
Xem đáp án
Đáp án A
Phương trình ion thu gọn là: H+ + OH- → H2O
Câu 15:
Dẫn từ từ CO2 vào dung dịch chỉ chứa 0,025 mol Ba(OH)2. Đồ thị dưới đây biểu diễn sự phụ thuộc của số mol kết tủa BaCO3 tạo thành theo số mol CO2.
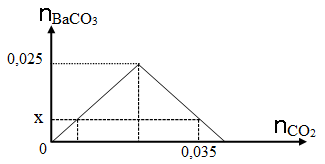
 Xem đáp án
Xem đáp án
Đáp án B
Phương trình hóa học:
Ba(OH)2 + CO2 → BaCO3↓ + H2O (1)
BaCO3 + CO2 + H2O → Ba(HCO3)2 (2)
Khi đạt đến kết tủa cực đại thì số mol BaCO3 là 0,025 mol, khi này số mol CO2 phản ứng là 0,025 mol (Bảo toàn nguyên tố cacbon)
Khi số mol CO2 là 0,035 mol thì đã xảy ra phương trình (2).
⟹ 0,035 = 0,025 + 0,025 – x
⟹ x = 0,015 mol
Câu 16:
Số liên kết xích-ma (Ϭ) trong phân tử C4H10 là:
 Xem đáp án
Xem đáp án
Đáp án B
Liên kết xích-ma là liên kết đơn. Liên kết đơn gồm C – C và C – H.
Số liên kết C – C là 4 – 1 = 3 liên kết.
Số liên kết C – H là 10 liên kết.
⟹ Tổng có 13 liên kết xích – ma.
Câu 17:
Hợp chất X có công thức đơn giản nhất là CH2O. Tỉ khối hơi của X so với hiđro bằng 30. Công thức phân tử của X là
 Xem đáp án
Xem đáp án
Đáp án B
Công thức phân tử của hợp chất X có dạng (CH2O)n.
Mà MX = 30.2 = 60
⟹ 30n =60 ⟹ n = 2
⟹ Công thức phân tử của X là C2H4O2.
Câu 18:
Hợp chất hữu cơ X (C, H, O và N) có công thức trùng với công thức đơn giản nhất, đốt cháy hoàn toàn 7,5 gam X, thu được 4,48 lít CO2; 1,12 lít N2 (các khí đều đo (đktc)) và 4,5 gam H2O. Số nguyên tử hiđro trong một phân tử X là
 Xem đáp án
Xem đáp án
Đáp án C
Theo bài ta có:
⟹
⟹
⟹
⟹ Công thức đơn giản nhất là C2H5O2N
Mà công thức phân tử trùng công thức đơn giản nhất
⟹ Công thức phân tử là C2H5O2N.
⟹ Số nguyên tử H là 5
Câu 19:
 Xem đáp án
Xem đáp án
Đáp án C
Độ bất bão hòa:
⟹ Phân tử chỉ có liên kết đơn.
Các công thức cấu tạo có thể có là:
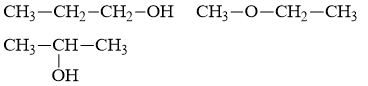
Câu 20:
Trong phòng thí nghiệm người ta điều chế HNO3 từ
 Xem đáp án
Xem đáp án
Đáp án C
Trong phòng thí nghiệm thì để điều chế axit HNO3 người ta dùng NaNO3 rắn và H2SO4 đặc.
Phương trình hóa học:
NaNO3 + H2SO4 đ HNO3 + NaHSO4
Câu 21:
Viết phương trình hóa học?
a) Viết phương trình hóa học dưới dạng phân tử và ion rút gọn của phản ứng xảy ra sau: (0,5đ)
CaCO3 + HCl
b) Viết phương trình nhiệt phân các muối trong các trường hợp sau: (1,5đ)
NH4NO3; NaNO3, MgCO3.
 Xem đáp án
Xem đáp án
a) Phương trình hóa học dạng phân tử:
CaCO3 + HCl → CaCl2 + CO2↑ + H2O
Phương trình ion thu gọn là:
CaCO3 + 2 → + CO2↑ + H2O
b)
NH4NO3 N2O + 2H2O
2NaNO3 2NaNO2 + O2
2Mg(NO3)2 2MgO + 4NO2 + O2Câu 22:
Đốt cháy hoàn toàn 4,4 gam hợp chất hữu cơ X (C, H, O). Dẫn sản phẩm cháy lần lượt qua bình (1) đựng dung dịch H2SO4 đặc, bình (2) đựng dung dịch KOH dư. Sau thí nghiệm, khối lượng bình (1) tăng 1,8 gam, khối lượng bình (2) tăng 6,6 gam. Tỉ khối của X đối với hiđro là 44. Xác định công thức của phân tử X.
 Xem đáp án
Xem đáp án
Ta có: ⟹ nH = 0,2 mol
⟹ nC = 0,15 mol
⟹
⟹ C : H : O = 3 : 4 : 3
⟹ Công thức đơn giản nhất là C3H4O3.
⟹ Công thức phân tử dạng là (C3H4O3)n.
⟹ 88n = 88
⟹ n = 1
⟹ Công thức phân tử của X là C3H4O3.
Câu 23:
Hòa tan hoàn toàn m gam Zn vào dung dịch HNO3 dư, thu được 0,448 ml khí NO (đktc, sản phẩm khử duy nhất). Tính giá trị của m.
 Xem đáp án
Xem đáp án
Phương trình hóa học:
3Zn + 8HNO3 → 3Zn(NO3)2 + 2NO + 4H2O
Ta có:
Bảo toàn electron ta có: 2.nZn = 3.nNO
⟹
⟹ Khối lượng kẽm phản ứng là: m = 0,03.65 = 1,95 gam
