15 đề Ôn luyện Hóa học cực hay có lời giải (Đề số 9)
-
1737 lượt thi
-
50 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Một chất khi thuỷ phân trong môi trường axit, đun nóng không tạo ra glucozơ. Chất đó là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 2:
Cặp chất không xảy ra phản ứng là
 Xem đáp án
Xem đáp án
Đáp án A
Al2O3 + 2NaOH → H2O + 2NaAlO2
H2O + K2O → 2KOH
2H2O + 2Na → H2 + 2NaOH
Câu 3:
Trong phòng thí nghiệm, người ta điều chế và thu khí oxi như hình vẽ dưới đây vì oxi

 Xem đáp án
Xem đáp án
Đáp án C
Câu 4:
Cho hỗn hợp X gồm 0,2 mol CH2=CHCOOH và 0,1 mol CH3CHO. Thể tích H2 (ở đktc) để phản ứng vừa đủ với hỗn hợp X là
 Xem đáp án
Xem đáp án
Đáp án D
nH2 = n CH2=CHCOOH + n CH3CHO = 0,3 mol
=> V = 6,72 lít
Câu 6:
Phát biểu nào sau đây không đúng
 Xem đáp án
Xem đáp án
Đáp án A
Do Cr(OH)3 là hiđroxit lưỡng tính nên Cr(OH)3 tác dụng được với dung dịch NaOH đặc
Câu 8:
Cho 10 gam hỗn hợp gồm Fe và Cu tác dụng với dung dịch H2SO4 loãng dư. Sau phản ứng thu được 2,24 lít khí hiđro (ở đktc), dung dịch X và m gam kim loại không tan. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án C
nFe = nH2 = 0,1 mol
Chất rắn không tan là Cu
=> m = 10 – mFe = 10 – 0,1 . 56 = 4,4g
Câu 9:
Dãy gồm các kim loại đều phản ứng với nước ở nhiệt độ thường tạo ra dung dịch có môi trường kiềm là
 Xem đáp án
Xem đáp án
Đáp án C
Câu 10:
Ứng với công thức phân tử C4H10O có bao nhiêu ancol là đồng phân cấu tạo của nhau
 Xem đáp án
Xem đáp án
Đáp án A
Công thức tính nhanh 2n-2 = 22 = 4
Câu 11:
Khi xà phòng hoá tristearin ta thu được sản phẩm là
 Xem đáp án
Xem đáp án
Đáp án D
tristearin có công thức là: (C17H35COO)3C3H5
(C17H35COO)3C3H5 + 3NaOH → 3C17H35COONa + C3H5(OH)3
Câu 12:
Chất tham gia phản ứng trùng ngưng là
 Xem đáp án
Xem đáp án
Đáp án A
Để có phản ứng trùng ngưng là các monome tham gia phản ứng phải có ít nhất 2 nhóm chức có khả năng phản ứng để tạo được liên kết với nhau
Câu 15:
Chất nào sau đây khi đun nóng với dung dịch NaOH thu được sản phẩm có anđehit
 Xem đáp án
Xem đáp án
Đáp án D
CH3–COO–CH2–CH=CH2 + NaOH → CH3–COONa + HO–CH2–CH=CH2
CH2=CH–COO–CH2–CH3 + NaOH→ CH2=CH–COONa + HO–CH2–CH3
CH3–COO–C(CH3)=CH2 + NaOH → CH3–COONa + HO–C(CH3)=CH2
CH3–COO–CH=CH–CH3 +NaOH → CH3–COONa + CH3 - CH2 - CHO
Câu 16:
Trung hoà 7,2 gam axit cacboxylic đơn chức, mạch hở cần 100 ml dung dịch NaOH 1M. Công thức cấu tạo của axit là
 Xem đáp án
Xem đáp án
Đáp án C
n axit = n NaOH = 0,1mol
=> mRCOOH = 7,2 : 0,1 = 72
=> R = 27 => CH2=CH-
Câu 17:
Khi cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 thấy có
 Xem đáp án
Xem đáp án
Đáp án B
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
Câu 18:
Cho các phản ứng:
H2NCH2COOH + HCl à H3N+CH2COOHCl-
H2NCH2COOH + NaOH à H2NCH2COONa + H2O
Hai phản ứng trên chứng tỏ axit aminoaxetic
 Xem đáp án
Xem đáp án
Đáp án B
Câu 21:
Các chất trong dãy nào sau đây đều tạo kết tủa khi cho tác dụng với dung dịch AgNO3 trong NH3 dư, đun nóng
 Xem đáp án
Xem đáp án
Đáp án B
Câu 22:
Tính bazơ của các hiđroxit được xếp theo thứ tự giảm dần từ trái sang phải là
 Xem đáp án
Xem đáp án
Đáp án D
Câu 24:
Hấp thụ hoàn toàn 4,48 lít khí SO2 (ở đktc) vào dung dịch chứa 16 gam NaOH, thu được dung dịch X. Khối lượng muối thu được trong dung dịch X là
 Xem đáp án
Xem đáp án
Đáp án A
nSO2 = 0,2 mol
n NaOH = 0,4 mol
k = nNaOH/nSO2 = 0,4/0,2=2
k=2 => pứ tạo 1 muối trung hòa.
PT:
SO2 + 2NaOH → Na2SO3+H2O
0.2----0.4------->0.2
mNa2SO3 = 126.0.2 = 25.2g
Câu 25:
Saccarozơ và glucozơ đều có phản ứng
 Xem đáp án
Xem đáp án
Đáp án A
Phản ứng đặc trưng của hợp chất có nhiều nhóm OH liền kề
Câu 27:
Dãy gồm hai chất chỉ có tính oxi hoá là
 Xem đáp án
Xem đáp án
Đáp án A
Chỉ có tính oxi hóa tức là các nguyên tố đã đạt trạng thái số oxi hóa cao nhất không thể nhận thêm e
Câu 29:
Số đồng phân amin bậc một ứng với công thức phân tử C4H11N là
 Xem đáp án
Xem đáp án
Đáp án B
Công thức tính nhanh đồng phân amin bậc 1: 2( n – 2) = 22 = 4
Câu 31:
Trung hoà 100 ml dung dịch KOH 1M cần dùng V ml dung dịch HCl 1M. Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án D
nH+ = nOH- = 0,1 mol
=> V = 100ml
Câu 33:
Cho phương trình phản ứng: aFeSO4 + bK2Cr2O7 + cH2SO4 → dFe2(SO4)3 + eK2SO4 + fCr2(SO4)3 + gH2O. Tỉ lệ a : b là
 Xem đáp án
Xem đáp án
Đáp án A
PTHH:
6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + K2SO4 + Cr2(SO4)3 + 7H2O
Tỉ lệ: a : b = 6 : 1
Câu 34:
ốn kim loạBi Na; Al; Fe và Cu được ấn định không theo thứ tự X, Y, Z, T biết rằng:
• X; Y được điều chế bằng phương pháp điện phân nóng chảy
• X đẩy được kim loại T ra khỏi dung dịch muối
• Z tác dụng được với dung dịch H2SO4 loãng nhưng không tác dụng được với dung dịch H2SO4 đặc nguội. X, Y, Z, T theo thứ tự là
 Xem đáp án
Xem đáp án
Đáp án D
-X; Y được điều chế bằng phương pháp điện phân nóng chảy
=> X, Y phải là kim loại mạnh đứng tử Al trở lên => X và Y là Na và Al- X đẩy được kim loại T ra khỏi dung dịch muối
=> X phải có tính khử mạnh hơn T và X không được phản ứng với H2O
=> X phải là Al => Y là Na-Z tác dụng được với dung dịch H2SO4 đặc nóng nhưng không tác dụng được với dung dịch H2SO4 đặc nguội
=> Z phải là Fe => T là CuVậy X, Y, Z, T theo thứ tự là: Al; Na; Fe; Cu
Câu 35:
Cho các polime sau: tơ nilon-6,6; poli(vinyl clorua); thủy tinh plexiglas; teflon; nhựa novolac; tơ visco, tơ nitron, cao su buna. Trong đó, số polime được điều chế bằng phản ứng trùng hợp là:
 Xem đáp án
Xem đáp án
Đáp án C
poli(vinyl clorua), thủy tinh plexiglas, teflon, tơ nitron, cao su buna
Câu 36:
Cho các chất: (1) axit picric; (2) cumen ; (3) xiclohexanol ; (4) 1,2- đihiđroxi- 4-metylbenzen ; (5) 4- metylphenol ; (6) α- naphtol. Các chất thuộc loại phenol là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 37:
Đốt cháy 6,72 gam kim loại M với oxi thu được 9,28 gam oxit. Nếu cho 5,04 gam M tác dụng hết với dung dịch HNO3 dư thu được dung dịch X và khí NO (là sản phẩm khử duy nhất). Thể tích NO (đktc) thu được là
 Xem đáp án
Xem đáp án
Đáp án B
nO2 = (9,28 – 6,72) : 32 = 0,08 mol
M → M+n + ne
O2 + 4e → 2O2-
0,08 0,32
Có tỉ lệ giữa phần tác dụng với oxi và tác dụng với HNO3 là 6,72/5,04 = 4/3
=> ne nhận = 0,32 : (4/3) = 0,24 mol
N+5 +3e→ N+2
0,24 0,08=> V = 1,792 lít
Câu 38:
Cho axit salixylic (axit o-hiđroxibenzoic) phản ứng với anhiđrit axetic, thu được axit axetylsalixylic (o-CH3COO-C6H4-COOH) dùng làm thuốc cảm (aspirin). Để phản ứng hoàn toàn với 43,2 gam axit axetylsalixylic cần vừa đủ V lít dung dịch KOH 1M. Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án A
n axit = 0,24 mol
n KOH = 3 n axit = 0,72 mol
=> V = 0,72 lí
Câu 39:
Cho các phản ứng sau:
a) FeO + HNO3 (đặc, nóng) →
c) Al2O3 + HNO3 (đặc, nóng) →
d) Cu + dung dịch FeCl3 →
e) CH3CHO + H2
f) glucozơ + AgNO3 (hoặc Ag2O) trong dd NH3 →
g) C2H4 + Br2 →
Dãy gồm các phản ứng đều thuộc loại phản ứng oxi hóa - khử là
 Xem đáp án
Xem đáp án
Đáp án C
a) FeO + HNO3 (đặc, nóng) → Fe(NO3)3 + NO2 + H2O
b) FeS + H2SO4 (đặc, nóng) →Fe2(SO4)3 + SO2 + H2O
d) Cu + dung dịch FeCl3 → CuCl2 + FeCl2
e) CH3CHO + H2 Ni, to → CH3-CH2OH
f) glucozơ + AgNO3 (hoặc Ag2O) trong dung dịch NH3 → C5H11O5-CHO + Ag2O → C5H11O5-COOH + 2Ag
g) C2H4 + Br2 → C2H4Br2
Những phản a , b , d , e , f , g có sự thay đổi số oxi hóa
Câu 40:
Cho 6,72 gam Fe vào 400 ml dung dịch HNO3 1M, đến khi phản ứng xảy ra hoàn toàn, thu được khí NO (sản phẩm khử duy nhất) và dung dịch X. Dung dịch X có thể hoà tan tối đa m gam Cu. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Số mol Fe=0,12(mol) số mol HNO3=0,4 (mol)
Fe+4HNO3→Fe(NO3)3+NO+2H2O Fe + 2Fe(NO3)3→3Fe(NO3)2
0,1 0,4 0,1 0,02 0,04
Fe(NO3)3 dư =0,1-0,04=0,06(mol)
Cu + 2Fe(NO3)3→Cu(NO3)2+2Fe(NO3)2
0,03 0,06
mCu=0,03.64=1,92(g)
Câu 41:
Đốt cháy hoàn toàn một lượng chất hữu cơ X thu được 3,36 lít khí CO2, 0,56 lít khí N2 (các khí đo ở đktc) và 3,15 gam H2O. Khi X tác dụng với dung dịch NaOH thu được sản phẩm có muối H2N-CH2-COONa. Công thức cấu tạo thu gọn của X là
 Xem đáp án
Xem đáp án
Đáp án B
Ta có: nC = nCO2 = 0,15
nN = 2.nN2 = 0,05
nH = 2.nH2O = 0,35
C:H:N = 0,15:0,35:0,05 = 3:7:1 (loại C, D).
X + NaOH tạo H2N-CH2-COONa thì X: H2N-CH2-COO-CH3
Câu 42:
Cho các câu sau:
(a) Điện phân dung dịch KCl.
(b) Điện phân dung dịch CuSO4.
(c) Cho Fe vào dung dịch CuSO4.
(d) Cho Zn vào dung dịch FeCl3 (dư).
(e) Nung Ag2S trong không khí.
(f) Cho Ba vào dung dịch CuSO4 (dư).
Số thí nghiệm thu được kim loại sau khi các phản ứng kết thúc là
 Xem đáp án
Xem đáp án
Đáp án D
a) AgNO3 → Ag + NO2 + 12O2b)4FeS2 + 11O2 → 2Fe2O3 + 8SO2c) 2H2O + 2KCl → Cl2 + H2 + 2KOHd) 2CuSO4 + 2H2O →2Cu + 2H2SO4 + O2
e) Fe + CuSO4 → Cu + FeSO4g) Zn + FeCl3 → ZnCl2 + FeCl2 h) Ag2S+O2 → 2Ag + SO2
i) Ba+CuSO4+2H2O → BaSO4+Cu(OH)2+H2
=> Các phản ứng a, d, e, h
Câu 43:
Sục 13,44 lít CO2 ( đktc) vào 200 ml dung dịch X gồm Ba(OH)2 1,5M và NaOH 1M . Sau phản ứng thu được m1 gam kết tủa và dung dịch X. Cho dung dịch X tác dụng với 200ml dung dịch BaCl2 1,2M; KOH 1,5M thu được m2 gam kết tủa. Giá trị của m2 là
 Xem đáp án
Xem đáp án
Đáp án D
nOH- = 0.8 có nCO2 = 0,6< nOH- < 2nCO2 => tạo 2 muối CO2 + 2OH- → CO32- + H2O x -----> 2x -----> x CO2 + OH- → HCO3- y ------> y -----> y x + y = 0.6 và 2x + y = 0.8
=> x = 0,2 và y = 0,4 nCO32- = x = 0,2 < nBa2+ = 0,3
=> nBaCO3= 0.2 mol dd X: 0,1 mol Ba2+; 0,4 mol HCO3-; 0,2 mol Na+ nBaCl2 = 0,24 = nBa2+ => tổng nBa2+ = 0.34 nKOH = 0,3 = nOH- < nHCO3- => OH- hếtHCO3- + OH- → CO32- + H2O 0,3<-----0,3 -----> 0,3 nCO32- = 0,3; nBa2+ = 0,34
=> nBaCO3 = 0,3 => m2 = 0,3 . 197 = 59,1g
Câu 44:
Cho 0,3 mol hỗn hợp X gồm H2NC3H5(COOH)2 (axit glutamic) và (H2N)2C5H9COOH (lysin) vào 400 ml dung dịch HCl 1 M, thu được dung dịch Y. Y phản ứng vừa hết với 800 ml dung dịch NaOH 1 M. Số mol lysin trong 0,15 mol hỗn hợp X là
 Xem đáp án
Xem đáp án
Đáp án A
Có nNaOH = 0,8 mol, nHCl = 0,4 mol
Gọi a, b là số mol của H2NC3H5(COOH)2 (axit glutamic) và (H2N)2C5H9COOH (lysin) trong hh X
=> a + b = 0,3 (1)
Coi hh ban đầu gồm a mol H2NC3H5(COOH)2 (axit glutamic) , b mol(H2N)2C5H9COOH (lysin) và 0,4 mol phản ứng với 0,8 mol NaOH
=> 2a + b + 0,4 = 0,8 (2)
Từ (1) và (2) => a = 0,1 và b = 0,2
=> Trong 0,3 mol X lysin chiếm 2/3 số mol
=> Trong 0,15 mol X có 0,1 mol lysin
Câu 45:
Tiến hành các thí nghiệm sau:
(a) Cho Mg vào dung dịch Fe2(SO4)3 dư
(b) Sục khí Cl2 vào dung dịch FeCl2
(c) Dẫn khí H2 dư qua bột CuO nung nóng
(d) Cho Na vào dung dịch CuSO4 dư
(e) Nhiệt phân AgNO3
(g) Đốt FeS2 trong không khí
(h) Điện phân dung dịch CuSO4 với điện cực trơ
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kim loại là
 Xem đáp án
Xem đáp án
Đáp án A
H2+ CuO àCu + H2O
AgNO3 à Ag + NO2 + O2
CuSO4 + H2O à Cu + O2 + H2SO4
Câu 46:
Bảng dưới đây ghi lại hiện tượng khi làm thí nghiệm với các chất sau ở dạng dung dịch nước : X, Y, Z, T và Q
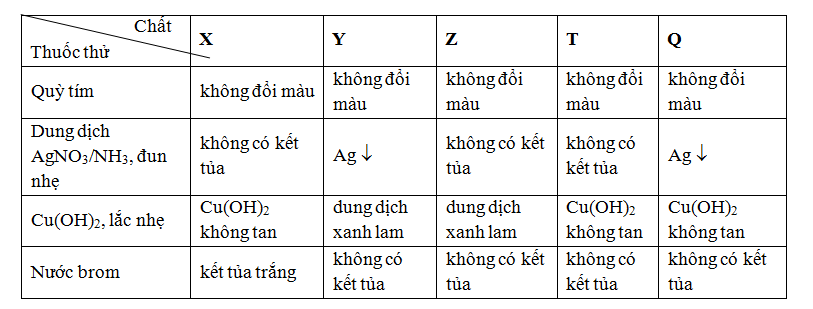
Các chất X, Y, Z, T và Q lần lượt là
 Xem đáp án
Xem đáp án
Đáp án B
Chỉ có thể chọn B hoặc C; nhìn vào bảng chon B thì phù hợp
Câu 47:
Cho 0,1 mol anđehit X phản ứng tối đa với 0,3 mol H2, thu được 9 gam ancol Y. Mặt khác 2,1 gam X tác dụng hết với lượng dư dung dịch AgNO3 trong NH3, thu được m gam Ag. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Ta có: 0,1.M + 0,3.2 = 9 M = 84; X phản ứng tối đa với H2 theo tỉ lệ 1:3 X có dạng CnH2n – 4Om
Khi đó: 14n + 16m – 4 = 84 14n + 16m = 88
Thỏa mãn m = 2 và n = 4: C4H4O2
X: OHC-CH=CH-CHO + AgNO3/NH3 4Ag
m = 4..108 = 10,8 gam.
Câu 48:
Hoà tan hỗn hợp X gồm Al, Fe trong 352 ml dung dịch HNO3 2,5M (vừa hết ), thu được dung dịch Y chứa 53,4 gam hỗn hợp muối và 2,24 lít hỗn hợp khí Z gồm NO, N2O (đktc) có tỉ khối hơi đối với H2 là 17,1. Cho dung dịch Y tác dụng với một lượng dung dịch NH3 dư, lọc thu được m gam kết tủa. Các phản ứng xảy ra hoàn toàn. Giá trị m gần giá trị nào nhất sau đây
 Xem đáp án
Xem đáp án
Đáp án B
Al, Fe +HNO3 0.88→ MuốiY (Fe3+ (có thể có Fe2+ ) Al3+ +NO3- + NH4+ : xmol
NO: 0,07 và N2O: 0,03
nNO3-= 0,07 . 3 + 0,03 . 8 + 8x + x = 0,45 + 9x
BTNT Nito
0,88 = 0,07 + 0,03 . 2 + x + 9x + 0,45 => x = 0,03
=>nNO3- = 0,72 => NH4NO3 = 0,03
=>nNO3-(KL) = 0.69
nOH- = nNO3-(KL)=0.69
mKl=53,4 - 0,72 . 62 – 0,03 . 18 = 8,22g
cho Y + NH3 => mkt = mKL + mOH- = 8,22 + 0,69 . 17=19,95g
Câu 50:
Đốt cháy hoàn toàn 13,36 gam hỗn hợp X gồm axit metacrylic, axit ađipic, axit axetic và glixerol (trong đó số mol axit metacrylic bằng số mol axit axetic) bằng O2 dư, thu được hỗn hợp Y gồm khí và hơi. Dẫn Y vào dung dịch chứa 0,38 mol Ba(OH)2, thu được 49,25 gam kết tủa và dung dịch Z. Đun nóng Z lại xuất hiện kết tủa. Cho 13,36 gam hỗn hợp X tác dụng với 140 ml dung dịch KOH 1M, sau khi các phản ứng xảy ra hoàn toàn, cô cạn dung dịch thu được chất rắn khan có khối lượng là
 Xem đáp án
Xem đáp án
Đáp án A
Axit metacrylic: CH2=C(CH3)-COOH, axit ađipic: HOOC-(CH2)4-COOH, axit axetic: CH3COOH
Vì số mol axit metacrylic bằng số mol axit axetic mà MC4H6O2 + MC2H4O2 = MC6H10O4 = 146

