Một nguyên tố có Z = 24, vị trí của nguyên tố đó là:
A. Chu kì 4, nhóm IA
B. Chu kì 4, nhóm VIA
C. Chu kì 2, nhóm IVA
D. Chu kì 4, nhóm VIB
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án D
Z = 24 => Cấu hình e: 1s22s22p63s23p63d54s1
=> Chu kỳ = số lớp electron = 4
=> Nhóm = VIB (vì: cấu hình e kết thúc ở dạng (n - 1)dxnsy => nhóm = (5 + 1)B = VIB)
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Một cation kim loại M có cấu hình e ở lớp ngoài cùng là 2s22p6. Vậy cấu hình e ở lớp ngoài cùng của nguyên tử kim loại M là :
Kim loại nào sau đây có thể tác dụng với nước ở điều kiện thường tạo ra dung dịch làm xanh giấy quỳ tím là
Cation M+ có cấu hình electron ở phân lớp ngoài cùng là 3p6. Nguyên tử M là:
Kim loại nào sau đây không bị thụ động hóa với dung dịch axit sunfuric đặc nguội?
Kim loại M3+ có cấu hình phân lớp ngoài cùng là 3d3. Vị trí của M trong bảng tuần hoàn các nguyên tố hóa học là?
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Mg (Z = 12) là
Kim loại tan trong dung dịch HCl và dung dịch H2SO4 đặc nguội là :
Trong số các kim loại Al, Zn, Fe, Ag. Kim loại nào không tác dụng được với O2?
I. Vị trí của kim loại trong bảng tuần hoàn
Các nguyên tố hóa học được phân thành kim loại và phi kim. Trong bảng tuần hoàn nguyên tố kim loại có mặt ở:
- Nhóm IA (trừ hiđro), nhóm IIA: các kim loại này là những nguyên tố s.
- Nhóm IIIA (trừ B), một phần của các nhóm IVA, VA, VIA: các kim loại này là những nguyên tố p.
- Các nhóm B (từ IB đến VIIIB): các kim loại chuyển tiếp, chúng là những nguyên tố d.
- Họ lantan và actini (xếp riêng thành hai hàng ở cuối bảng): các kim loại thuộc hai họ này là những nguyên tố f.
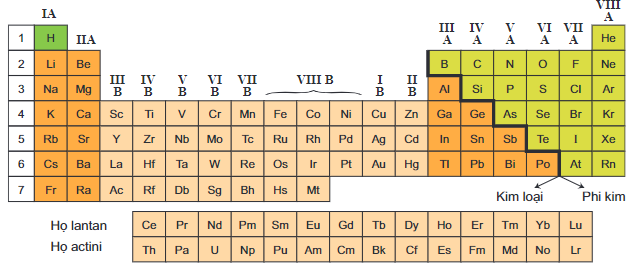
Vị trí của các nguyên tố kim loại trong bảng tuần hoàn
II. Cấu tạo của kim loại
1. Cấu tạo nguyên tử
- Nguyên tử của hầu hết các nguyên tố kim loại có 1, 2 hoặc 3 electron ở lớp ngoài cùng.
Ví dụ:
+ Na: [Ne]3s1 có 1electron ở lớp ngoài cùng.
+ Mg: [Ne]3s2 có 2 electron ở lớp ngoài cùng.
+ Al: [Ne]3s23p1 có 3 electron ở lớp ngoài cùng.
- Trong chu kì, nguyên tử của nguyên tố kim loại có bán kính nguyên tử lớn hơn và điện tích hạt nhân nhỏ hơn so với các nguyên tử của nguyên tố phi kim.
Ví dụ xét với chu kì 3:
|
Nguyên tử |
11Na |
12Mg |
13Al |
14Si |
15P |
16S |
17Cl |
|
rnt |
0,157 |
0,136 |
0,125 |
0,117 |
0,110 |
0,104 |
0,099 |
2. Cấu tạo tinh thể
- Ở nhiệt độ thường, trừ thủy ngân ở thể lỏng, còn các kim loại khác ở thể rắn, có cấu tạo tinh thể.
- Trong tinh thể kim loại, nguyên tử và ion kim loại nằm ở những nút mạng của tinh thể. Các electron hóa trị liên kết yếu với hạt nhân nên dễ tách ra khỏi nguyên tử và chuyển động tự do trong mạng tinh thể.
- Có ba kiểu mạng tinh thể kim loại đặc trưng là: lập phương tâm khối, lập phương tâm diện và lục phương.
a) Mạng tinh thể lục phương
- Đặc điểm: Các nguyên tử, ion kim loại nằm trên các đỉnh và tâm các mặt của hình lục giác đứng và ba nguyên tử, ion nằm phía trong của hình lục giác.
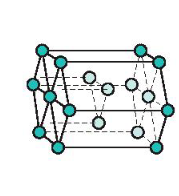
Mạng tinh thể lục phương
- Trong tinh thể, thể tích của các nguyên tử và ion kim loại chiểm 74%, còn lại 26% là không gian trống.
- Thuộc loại này có các kim loại: Be, Mg, Zn …
b) Mạng tinh thể lập phương tâm diện
- Đặc điểm: Các nguyên tử và ion kim loại nằm trên các đỉnh và tâm các mặt của hình lập phương.
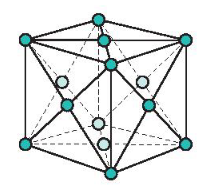
Mạng tinh thể lập phương tâm diện
- Trong tinh thể, thể tích của các nguyên tử và ion kim loại chiểm 74%, còn lại 26% là không gian trống.
- Thuộc loại này có các kim loại: Cu, Ag, Au, Al …
c) Mạng tinh thể lập phương tâm khối
- Đặc điểm: Các nguyên tử và ion kim loại nằm trên các đỉnh và tâm của hình lập phương.
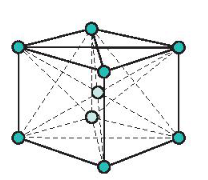
Mạng tinh thể lập phương tâm khối
- Trong tinh thể, thể tích của các nguyên tử và ion kim loại chỉ chiếm 68%, còn lại 32% là các không gian trống.
- Thuộc loại này có các kim loại: Li, Na, K, V, Mo …
3. Liên kết kim loại
Liên kết kim loại là liên kết được hình thành giữa nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các electron tự do.