Một bộ nguồn điện gồm 30 pin mắc thành 3 nhóm nối tiếp, mỗi nhóm có 10 pin mắc song song, mỗi pin có suất điện động 0,9V và điện trở trong . Một bình điện phân đựng dung dịch có điện trở được mắc vào hai cực của bộ nguồn nói trên. Anốt của bình điện phân bằng đồng. Khối lượng đồng bám vào catốt của bình trong thời gian 50 phút là? Biết đồng có A=64, n=2
A. 0,0131g
B. 1,31g
C. 0,0113g
D. 0,0311g
 Giải bởi Vietjack
Giải bởi Vietjack
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Điện phân cực dương tan một dung dịch trong 20 phút thì khối lượng cực âm tăng thêm 4 gam. Nếu điện phân trong một giờ với cùng cường độ dòng điện như trước thì khối lượng cực âm tăng thêm là:
Khi điện phân dương cực tan, nếu tăng cường độ dòng điện và thời gian điện phân lên 2 lần thì khối lượng chất giải phóng ra ở điện cực
Cho mạch điện như hình vẽ:
. Bình điện phân chứa dung dịch đồng sunfat với hai cực bằng đồng. Đèn ghi . là một biến trở. Điều chỉnh thì đèn sáng bình thường. Điện trở của bình điện phân là:
Bình điện phân có anốt làm bằng kim loại của chất điện phân có hóa trị 2. Cho dòng điện 0,2A chạy qua bình trong 16 phút 5 giây thì có 0,064g chất thoát ra ở điện cực. Kim loại dùng làm anốt của bình điện phân là
Đồ thị biểu diễn sự phụ thuộc giữa khối lượng chất giải phóng ra ở điện cực của bình điện phân và điện lượng tải qua bình
Đương lượng điện hóa của chất điện phân trong bình này là:
Khi điện phân dung dịch với cực dương là Ag biết khối lượng mol của bạc là 108. Cường độ dòng điện chạy qua bình điện phân để trong 1h để có 27 gam Ag bám ở cực âm là
Cho mạch điện như hình vẽ:
. Bình điện phân dung dịch , anot bằng đồng, có điện trở . Cường độ dòng điện qua bình điện phân có giá trị?
Hai bình điện phân: ( và ) mắc nối tiếp. Sau một khoảng thời gian, bình thứ nhất giải phóng một lượng sắt là 1,4g. Lượng đồng giải phóng ở bình thứ hai trong cùng khoảng thời gian đó là bao nhiêu? Biết nguyên tử lượng của đồng và sắt là 64 và 56, hóa trị của đồng và sắt là 2 và 3
I. Thuyết điện li
Trong dung dịch, các hợp chất hóa học như axit, bazơ và muối bị phân li (một phần hoặc toàn bộ) thành các nguyên tử (hoặc nhóm nguyên tử) tích điện gọi là ion; ion có thể chuyển động tự do trong dung dịch và trở thành hạt tải điện.
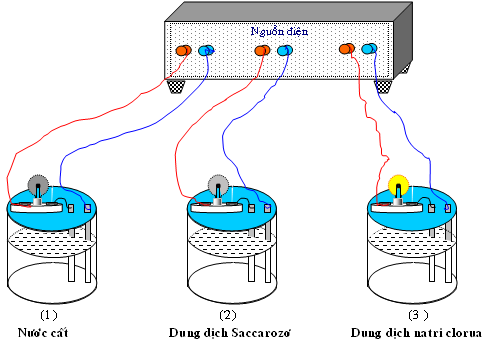
Các ion dương và âm vốn đã tồn tại sẵn trong các phân tử axit, bazo và muối. Chúng liên kết với nhau bằng lực Culong. Khi tan vào dung môi khác thì lực Culong yếu đi và một số phân tử bị chuyển động nhiệt tách thành các ion tự do.
Như vậy: những dung dịch và chất nóng chảy này được gọi là chất điện phân.
II. Bản chất dòng điện trong chất điện phân
- Dòng điện trong lòng chất điện phân là dòng ion dương và ion âm chuyển động có hướng theo hai chiều ngược nhau.
+ Ion dương chạy về phía catot nên gọi là cation.
+ Ion âm chạy về phía anot nên gọi là anion.
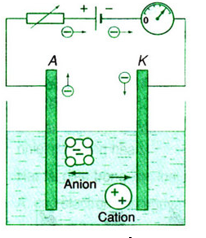
Chiều của các hạt tải điện trong chất điện phân
- Chất điện phân không dẫn điện tốt bằng kim loại. Do mật độ ion trong chất điện phân thường nhỏ hơn mật độ electron tự do trong kim loại, đồng thời khối lượng và kích thước của ion lớn hơn electron tự do nên tốc độ của chuyển động có hướng của chúng nhỏ hơn, môi trường dung dịch mất trật tự nên cản trở chuyển động mạnh.
- Dòng điện trong chất điện phân không chỉ tải điện lượng mà còn tải cả vật chất đi theo. Tới điện cực chỉ có các electron có thể đi tiếp, còn lượng vật chất đọng lại ở điện cực, gây ra hiện tượng điện phân.
III. Các hiện tượng diễn ra ở điện cực. Hiện tượng dương cực tan
Ta xét bình điện phân dung dịch có điện cực bằng đồng.
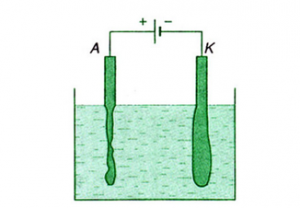
- Khi dòng điện chạy qua, cation chạy về catôt, về nhận electron từ nguồn điện đi tới. Ta có ở các điện cực:
+ Ở catôt: + → Cu
+ Ở anôt: Cu → +
- Khi anion chạy về anôt, nó kéo ion vào dung dịch. Như vậy, đồng ở anôt sẽ tan dần vào trong dung dịch.
Kết luận: Hiện tượng dương cực tan xảy ra khi các anion đi tới anot kéo các ion kim loại của điện cực vào trong dung dịch.
IV. Các định luật Fa-ra-đây
1. Định luật Fa-ra-đây thứ nhất
Khối lượng vật chất được giải phóng ở điện cực của bình điện phân tỉ lệ thuận với điện trường chạy qua bình đó: m = k.q
Trong đó k gọi là đương lượng điện hóa của chất được giải phóng ở điện cực.
2. Định luật Fa-ra-đây thứ hai
Đương lượng điện hóa k của một nguyên tố tỉ lệ với đương lượng gam của nguyên tố đó. Hệ số tỉ lệ là , trong đó F gọi là số Fa-ra-đây.
Kết hợp hai định luật Fa-ra-đây, ta được công thức Fa-ra-đây:
Trong đó:
+ F = 96500 C/mol
+ A là khối lượng mol (g/mol)
+ n là hóa trị
+ m là khối lượng chất được giải phóng ở điện cực (g)
+ I là cường độ dòng điện (A)
+ t là thời gian dòng điện chạy qua (s)
V. Ứng dụng của hiện tượng điện phân
Hiện tượng điện phân có nhiều ứng dụng trong thực tế sản xuất và đời sống như luyện nhôm, tinh luyện đồng, điều chế clo, xút, mạ điện, đúc điện…
1. Luyện nhôm
Công nghệ luyện nhôm chủ yếu dựa vào hiện tượng điện phân quặng nhôm nóng chảy.
+ Quặng nhôm phổ biến là bôxit giàu nhôm ôxit . Nhiệt độ nóng chảy của rất cao nên người ta pha thêm vào quặng để hạ nhiệt nóng chảy xuống còn . Bể điện phân có cực dương là quặng nhôm nóng chảy, cực âm bằng than, chất điện phân là muối nhôm nóng chảy, dòng điện chạy qua khoảng .

Công nghiệp luyện nhôm
2. Mạ điện
Bể điện phân lúc này gọi là bể mạ có anot là một tấm kim loại để mạ, catot là vật cần mạ.
Chất điện phân thường là dung dịch muối kim loại để mạ (nếu mạ niken ta dùng tan trong nước,…) thêm một số chất phụ gia để lớp mạ bám chắc, bền đẹp hơn. Dòng điện qua bể mạ được chọn một cách thích hợp để đảm bảo chất lượng của lớp mạ.


Mạ điện