Cho 30,6 gam hỗn hợp Cu, Fe, Zn tác dụng với dung dịch loãng dư thu được dung dịch chứa 92,6 gam muối khan ( không chứa muối amoni ). Nung hỗn hợp muối đến khối lượng không đổi, thu được m gam rắn. Giá trị của m là
A. 38,6.
B. 46,6.
C. 84,6.
D. 76,6.
 Giải bởi Vietjack
Giải bởi Vietjack
Chọn A
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Có các mệnh đề sau :
(1) Các muối nitrat đều tan trong nước và đều là chất điện li mạnh.
(2) Ion có tính oxi hóa trong môi trường axit.
(3) Khi nhiệt phân muối nitrat rắn ta đều thu được khí
(4) Hầu hết muối nitrat đều bền nhiệt.
Trong các mệnh đề trên, những mệnh đề đúng là
Hòa tan 23,2 gam hỗn hợp X gồm và CuO có cùng khối lượng vào dung dịch vừa đủ chứa 0,77 mol thu được bằng dung dịch Y và khí Z gồm NO và . Khối lượng mol trung bình của Z bằng
Trong các phản ứng sau, phản ứng nào HNO3 không đóng vai trò chất oxi hóa ?
Chia 20 gam hỗn hợp gồm Mg, Al, Zn thành hai phần bằng nhau. Đốt cháy hoàn toàn phần một trong O2 dư thu được 21 gam hỗn hợp oxit. Phần hai hòa tan trong dung dịch đặc, nóng dư thu được V (lít) (sản phẩm khử duy nhất, (đktc)). Giá trị của V là
Hòa tan hoàn toàn hỗn hợp X gồm 0,2 mol Mg và 0,03 mol MgO trong V lít dung dịch 0,5M vừa đủ thu được dung dịch Y và 0,896 lít (đktc) khi duy nhất. Giá trị của V và tổng khối lượng muối thu được trong Y lần lượt là
Để điều chế 5 lít dung dịch 21% (D = 1,2g/ml) bằng phương pháp oxi hóa với hiệu suất toàn quá trình là 80%, thể tích khí (đktc) tối thiểu cần dùng là
Nung nóng được chất rắn X và khí Y. Dẫn khí Y vào cốc nước được dung dịch Z. Cho toàn bộ X vào Z thấy X tan một phần và thoát ra khí NO duy nhất. Giả thiết các phản ứng xảy ra hoàn toàn. Thành phần phần trăm khối lượng của X không tan trong Z là
Chỉ sử dụng dung dịch loãng, có thể nhận biết được bao nhiêu chất rắn riêng biệt sau: , , , ?
Khi nhiệt phân, nhóm các muối nitrat cho sản phẩm kim loại, khí là:
Cho 11,6 gam muối tác dụng vừa đủ với dung dịch được hỗn hợp khí , NO và dung dịch X. Khi thêm dung dịch HCl (dư) vào dung dịch X, thì dung dịch thu được hòa tan tối đa bao nhiêu bột đồng kim loại, biết rằng có khí NO bay ra?
A. AXIT NITRIC
I. Cấu tạo phân tử
- Công thức cấu tạo của HN:
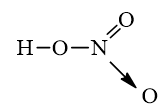
Chú ý: Mũi tên trong công thức cấu tạo trên cho biết cặp electron liên kết chỉ do nguyên tử N cung cấp.
- Trong hợp chất HN, nitơ có số oxi hóa cao nhất là +5.
II. Tính chất vật lý
- Axit nitric tinh khiết là chất lỏng không màu, bốc khói mạnh trong không khí ẩm.
- Axit nitric không bền, khi có ánh sáng phân hủy một phần sinh ra khí N. Khí này tan trong dung dịch axit, làm cho dung dịch có màu vàng.
4HN 4N↑ + ↑ + 2O
- Axit nitric tan vô hạn trong nước. Trong phòng thí nghiệm thường có loại HN đặc nồng độ 68%, D = 1,4 g/cm^3.
III. Tính chất hóa học
1. Tính axit
- Axit nitric là một trong số các axit mạnh nhất, trong dung dịch phân li hoàn toàn:
- Dung dịch axit HN có đầy đủ tính chất của một dung dịch axit: làm đỏ quỳ tím, tác dụng với oxit bazơ, bazơ, muối của axit yếu hơn.
Thí dụ:
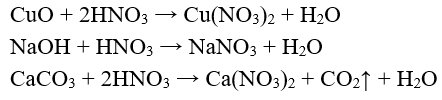
2. Tính oxi hóa
- HN có tính oxi hóa mạnh.
- Kim loại hay phi kim khi gặp axit HN đều bị oxi hóa lên trạng thái có mức oxi hóa cao nhất.
a) Tác dụng với kim loại
- HN oxi hóa hầu hết các kim loại trừ vàng (Au) và platin (Pt).
* Với những kim loại có tính khử yếu: Cu, Ag, ...
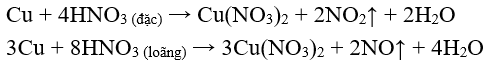
* Khi tác dụng với những kim loại có tính khử mạnh hơn: Mg, Zn, Al, ... thì HN loãng có thể bị khử đến O, hoặc NN.
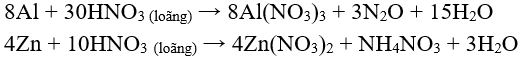
* Lưu ý: Fe, Al, Cr bị thụ động hóa trong dung dịch HN đặc, nguội.
b) Tác dụng với phi kim
- Khi đun nóng, HN đặc có thể tác dụng với phi kim: C, P, S, …(trừ và halogen).
Thí dụ:
S + 6HN (đ) → S + 6N↑ + 2O
c) Tác dụng với hợp chất
- S, HI, S, FeO, muối sắt (II), … có thể tác dụng với HN.
Thí dụ:
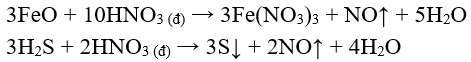
- Nhiều hợp chất hữu cơ như giấy, vải, dầu thông, … bốc cháy khi tiếp xúc với HN đặc.
IV. Ứng dụng
- Phần lớn sử dụng để điều chế phân đạm NN, …
- Ngoài ra, sử dụng sản xuất thuốc nổ, thuốc nhuộm, dược phẩm, …
V. Điều chế
1. Trong phòng thí nghiệm
Axit HN được điều chế bằng cách cho natri nitrat hoặc kali nitrat rắn tác dụng với axit S đặc, nóng:
NaN (rắn) + S (đặc) HN + NaHS
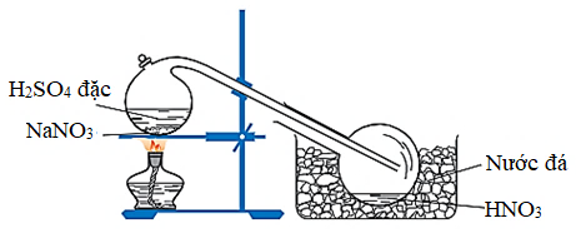
Hình 1: Điều chế axit nitric trong phòng thí nghiệm
2. Trong công nghiệp
- Được điều chế từ N qua ba giai đoạn:
N NO N HN.
a) Oxi hóa khí amoniac bằng oxi không khí
4N + 5 4NO + 6O;
b) Oxi hóa NO thành N bằng oxi không khí ở điều kiện thường
2NO + → 2N
c) Chuyển hóa N thành HN
4N + 2O + → 4HN
Dung dịch HN thu được thường có nồng độ 52 – 68%. Để có HN có nồng độ cao hơn 68% người ta thường chưng cất axit này với HN đậm đặc.
B. MUỐI NITRAT
- Muối của axit nitric được gọi là nitrat.
Thí dụ: natri nitrat NaN, bạc nitrat AgN,…
I. Tính chất vật lý
- Tất cả các muối nitrat đều dễ tan trong nước, là chất điện li mạnh trong dung dịch phân li hoàn toàn thành các ion.
Thí dụ:
Ca(N)2 → Ca2+ + 2
- Ion không màu, màu của 1 số muối nitrat là do màu của cation kim loại.
II. Tính chất hóa học
1. Nhiệt phân muối nitrat
a) Muối nitrat của các kim loại hoạt động mạnh (kali, natri,…)
Muối nitrat Muối nitrit + ↑
Thí dụ:
2NaN 2NaN + ↑
b) Muối nitrat của Mg, Zn, Fe, Pb, Cu,…
Muối nitrat Oxit kim loại + N↑ + ↑
Thí dụ:
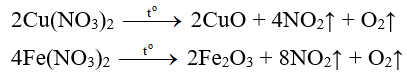
c) Muối nitrat của những kim loại Ag, Au, Hg,…
Muối nitrat Kim loại + N↑ + ↑
Thí dụ:
2AgN 2Ag + 2N↑ + ↑
2. Nhận biết ion nitrat
- Trong môi trường trung tính không có tính oxi hóa.
- Trong môi trường axit, ion thể hiện tính oxi hóa giống như HN.
⇒ Thuốc thử dùng để nhận biết ion là một ít vụn đồng và dung dịch S loãng, đun nóng.
Hiện tượng: dung dịch có màu xanh, khí không màu hóa nâu đỏ trong không khí.
3Cu + 8H+ + 2 → 3C+ + 2NO↑ + 4O
2NO + (không khí) → 2N (màu nâu đỏ)
III. Ứng dụng
- Các muối nitrat được sử dụng chủ yếu làm phân bón hóa học (phân đạm) trong nông nghiệp như NN, NaN, KN, Ca(N)2.

Hình 2: Một số loại phân đạm
- KN còn được sử dụng để chế thuốc nổ đen (thuốc nổ khói). Thuốc nổ đen chứa 75% KN, 10%S và 15% C.
C. Chu trình của nitơ trong tự nhiên
Nguyên tố nitơ rất cần cho sự sống trên Trái Đất. Trong tự nhiên, luôn luôn diễn ra các quá trình chuyển hóa nitơ từ dạng này sang dạng khác theo một chu trình tuần hoàn khép kín.
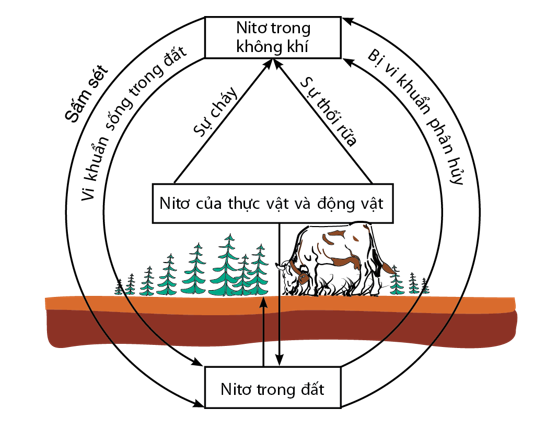
Hình 3: Chu trình của nitơ trong tự nhiên