Sục V lít khí (đktc) vào 200 ml dung dịch 1M thu dược dung dịch X chứa hai muối. Cho nước vôi trong dư vào dung dịch X, thu dược 35 gam kết tủa. Giá trị của V là
A. 2,24.
B. 3,136.
C. 2,8.
D. 3,36.
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án D
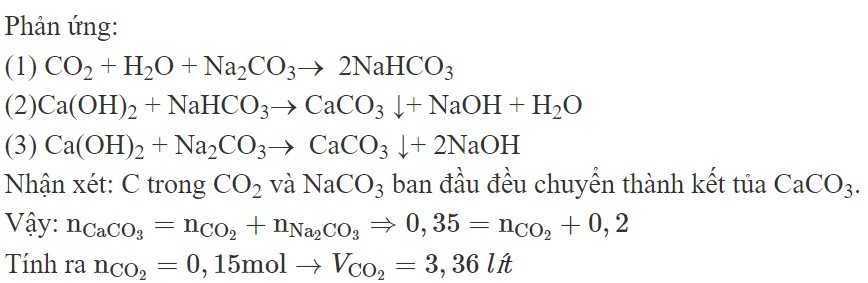
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Trộn 100 ml dung dịch HCl có pH = 1 với 100 ml dung dịch gồm KOH 0,1M và NaOH aM, thu được 200 ml dung dịch có pH = 12. Giá trị của a là
Cho các phản ứng sau :
Trong các phản ứng trên, số phản ứng có phương trình ion thu gọn là
Cho từ từ 150 ml dung dịch HCl 1M vào 500 ml dung dịch A gồm xM và yM thì thu được 1,008 lít khí (đktc) và dung dịch B. Cho dung dịch B tác dụng với dung dịch dư thì thu được 29,55 gam kết tủa. Giá trị của x và y lần lượt là
Dung dịch X chứa 0,4 mol HCl, dung dịch Y chứa 0,2 mol và 0,3 mol . Nếu cho từ từ dung dịch X vào dung dịch Y thì thoát ra a mol khí . Nếu cho từ từ dung dịch Y vào dung dịch X thì thoát ra b mol khí. Giá trị của a và b lần lượt là
Cho từ từ 200 ml dung dịch 1,0M vào 200 ml dung dịch chứa và thu được 1,12 lít (đktc). Nồng độ của là
Dung dịch A có a mol , b mol , c mol và d mol . Biểu thức nào dưới đây biểu thị đúng sự liên quan giữa a, b, c, d ?
Cho dung dịch A chứa xM và Na2CO3 yM. Lấy 10 ml dung dịch A tác dụng vừa đủ với 10 ml dung dịch NaOH 1M. Mặt khác, 5 ml dung dịch A tác dụng vừa hết với 10 ml dung dịch HCl 1M. giá trị của x và y lần lượt là
Cho các nhóm ion sau :
; ; ; .
Trong các nhóm trên, những nhóm tồn tại trong cùng một dung dịch là
Hỗn hợp X chứa có số mol bằng nhau. Cho hỗn hợp X vào nước (dư), đun nóng , thu được dung dịch chứa chất tan là:
Cho dung dịch X gồm 0,06 mol 0,01 mol , 0,03 mol 0,07 mol và 0,06 mol . Để loại bỏ hết ion cần một lượng vừa đủ dung dịch chứa a gam .Giá trị của a là
Cho các phản ứng sau:
Trong các phản ứng trên, những phản ứng có cùng phương trình ion thu gọn là
Một dung dịch chứa a mol , 2mol , 4 mol , 2 mol . Cô cạn dung dịch này ta được lượng chất rắn có khối lượng là
Kiến thức trọng tâm
1. Axit - Bazơ
- Theo A-rê-ni-ut, thì:
+ Axit là chất tan trong nước phân li ra ion H+.
Thí dụ: HCl → H+ + Cl-
+ Bazơ khi tan trong nước phân li ra ion OH-.
Thí dụ: KOH → K+ + OH-
2. Hiđroxit lưỡng tính
- Hiđroxit lưỡng tính khi tan trong nước vừa phân li như axit, vừa có thể phân li như bazơ.
Thí dụ: Zn, Al, Pb, Sn, Cr, …
Phương trình hóa học minh họa:
3. Muối
- Hầu hết các muối khi tan trong nước phân li hoàn toàn ra cation kim loại (hoặc ) và anion gốc axit.
FeC → F+ + 2Cl-
- Nếu gốc axit còn chứa hiđro có tính axit, thì gốc đó tiếp tục phân li yếu ra cation H+ và anion gốc axit.
Thí dụ:
NaHS → Na+ + HS-
4. Tích số ion của nước
= [H+].[OH-] = 10^-14 M (ở 25C). Một cách gần đúng, có thể coi giá trị của tích số này là hằng số cả trong dung dịch loãng của các chất khác nhau.
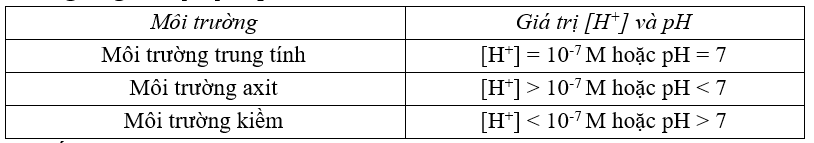
5. Ý nghĩa giá trị [H+] và pH
6. Chất chỉ thị
Các chất chỉ thị thường dùng: quỳ tím, phenolphtalein và chất chỉ thị vạn năng.
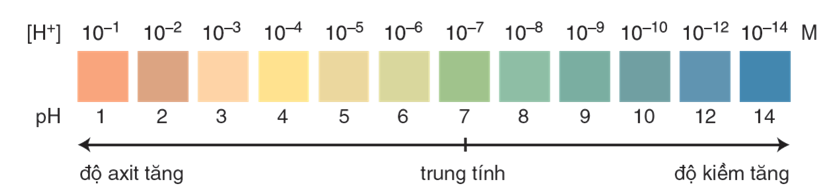
Hình 1: Màu của chất chỉ thị vạn năng thay đổi theo pH của dung dịch
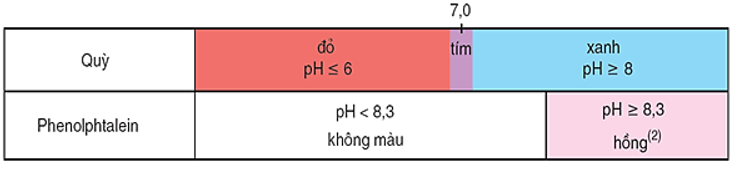
Hình 2: Màu của quỳ và phenolphtalein trong dung dịch ở các khoảng pH khác nhau
7. Phản ứng trao đổi ion
Phản ứng trao đổi ion trong dung dịch chất điện li chỉ xảy ra khi các ion kết hợp với nhau tạo thành ít nhất một trong các chất sau:
- chất kết tủa.
- chất điện li yếu.
- chất khí.
Thí dụ:
NS + BaC → 2NaCl + BaS↓
HCl + NaOH → NaCl + O
Fe + S loãng → FeS + ↑
8. Phương trình ion rút gọn
- Cho biết bản chất của phản ứng trong dung dịch các chất điện li.
- Trong phương trình ion rút gọn, loại bỏ những ion không tham gia phản ứng, còn những chất kết tủa, chất khí, chất điện li yếu được giữ nguyên dưới dạng phân tử.
Thí dụ:
Phương trình phân tử:
Zn + 2HCl → ZnC + ↑
Phương trình ion rút gọn: