Tìm hiểu tính tẩy màu của khí chlorine ẩm
Giải Hóa 10 Bài 21 - Kết nối tri thức: Nhóm halogen
Hoạt động trang 109 Hóa học 10: Tìm hiểu tính tẩy màu của khí chlorine ẩm
Tiến hành:
Đính một mẩu giấy màu ẩm vào dây kim loại gắn với nút đậy bình tam giác. Sau đó, đưa mẩu giấy vào bình tam giác chứa khí chlorine (Hình 21.6).
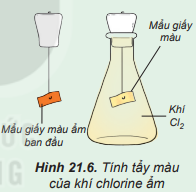
Quan sát hiện tượng và thực hiện yêu cầu sau:
1. Nhận xét màu của mẩu giấy trước và sau khi cho vào bình tam giác. Giải thích.
2. Xác định vai trò của chlorine trong phản ứng với nước, tại sao nói chlorine tự oxi hoá - tự khử trong phản ứng này?
Lời giải:
1. Sau khi cho mẩu giấy màu ẩm vào bình tam giác thì mẩu giấy mất màu do một phần khí Cl2 tác dụng với nước sinh ra HClO có tính oxi hóa mạnh, có khả năng diệt khuẩn và tẩy màu.
Cl2 + H2O ⇌ HCl + HClO
2. Sự thay đổi số oxi hóa của các chất trong phản ứng:
Trong phản ứng của chlorine với nước thì số oxi hóa của chlorine vừa tăng vừa giảm
⇒ Chlorine vừa đóng vai trò là chất oxi hóa vừa đóng vai trò là chất khử.
⇒ Ta nói chlorine tự oxi hoá - tự khử trong phản ứng này.
Xem thêm lời giải bài tập Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Câu hỏi 1 trang 105 Hóa học 10: Kể tên một số hợp chất phổ biến của halogen trong tự nhiên....
Hoạt động 2 trang 105 Hóa học 10: Tham khảo Bài 12 (Liên kết cộng hoá trị), hãy...
Câu hỏi 2 trang 106 Hóa học 10: Trong tự nhiên, các nguyên tố halogen tồn tại ở dạng hợp chất...
Câu hỏi 4 trang 107 Hóa học 10: Từ Bảng 21.2, nhận xét xu hướng biến đổi nhiệt độ nóng chảy...
Câu hỏi 6 trang 109 Hóa học 10: Một nhà máy nước sử dụng 5 mg Cl2 để khử trùng 1 L nước sinh hoạt...
Hoạt động trang 109 Hóa học 10: Tìm hiểu tính tẩy màu của khí chlorine ẩm...
Hoạt động trang 110 Hóa học 10: Phản ứng thế của một số muối halide...
Bài viết liên quan
- Xét các phản ứng hoá học: H2(g) + X2(g) ⟶ 2HX(g) (X là các halogen)
- Một nhà máy nước sử dụng 5 mg Cl2 để khử trùng 1 L nước sinh hoạt
- Khí Cl2 phản ứng với dung dịch sodium hydroxide nóng tạo thành sodium chloride
- Phản ứng thế của một số muối halide
- Viết phương trình hoá học minh hoạ tính oxi hoá giảm dần trong dãy Cl2, Br2, I2
